题目内容
8.一种塑料抗氧化剂C可通过下列反应合成: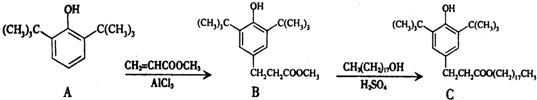
下列有关叙述正确的是( )
| A. | 物质A是苯甲醇的同系物 | |
| B. | 物质B能发生取代、加聚等反应 | |
| C. | 可用氯化铁溶液鉴别物质C中是否含有CH3(CH2)17OH杂质 | |
| D. | 1 mol物质C与足量NaOH溶液反应,最多可消耗2 mol NaOH |
分析 A.A属于酚类物质;
B.B中含有苯环、酚羟基和酯基,具有苯、酚和酯的性质;
C.C中含有酚羟基,CH3(CH2)17OH中含有醇羟基,酚能发生显色反应;
D.能和NaOH反应的有酚羟基和酯基水解生成的羧基.
解答 解:A.A中含有酚羟基,属于酚类物质,不属于醇,所以与苯甲醇不是同系物,故A错误;
B.B中含有苯环、酚羟基和酯基,具有苯、酚和酯的性质,能发生加成反应、取代反应、水解反应,但不能发生加聚反应,故B错误;
C.C中含有酚羟基,CH3(CH2)17OH中含有醇羟基,酚能发生显色反应,用氯化铁能检验C,但不能检验CH3(CH2)17OH,故C错误;
D.能和NaOH反应的有酚羟基和酯基水解生成的羧基,所以1 mol物质C与足量NaOH溶液反应,最多可消耗2 mol NaOH,故D正确;
故选D.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析判断能力,涉及基本概念、物质检验等知识点,易错选项是D.

练习册系列答案
相关题目
18.有反应mA(g)+nB(g)?wC(g),测得在同一时间内A每分钟减少0.15mol•L-1,B每分钟减少0.05mol•L-1,C每分钟增加0.1mol•L-1,则下列叙述不正确的是( )
| A. | m:n:w=3:1:2 | |
| B. | 体积和温度不变时,若在前10s内A减少了x mol,则B在前20s内减少$\frac{2x}{3}$ mol | |
| C. | 体积和温度不变时,随反应进行压强逐渐下降,一段时间后压强保持恒定不变 | |
| D. | 单位时间内反应物浓度的减少大于生成物浓度的增加 |
19.金属钛(Ti)被誉为21世纪金属,具有良好的生物相容性,它兼具铁的高强度和铝的低密度.其单质和化合物具有广泛的应用价值.氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品.以TiCl4为原料,经过一系列反应可以制得Ti3N4和纳米TiO2(如图1).
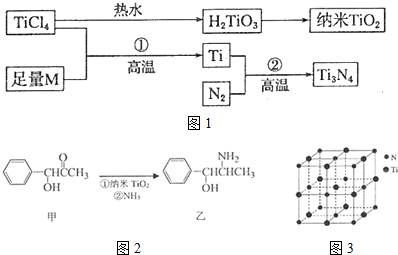
图中的M是短周期金属元素,M的部分电离能如下表:
请回答下列问题:
(1)Ti的基态原子外围电子排布式为3d24s2;
(2)M是Mg(填元素符号),该金属晶体的堆积模型为六方最密堆积,配位数为12;
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图2所示.化合物甲的分子中采取sp2方式杂化的碳原子有7个,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺序为O>N>C;
(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图3所示,该晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为$\frac{4×62}{{N}_{A}×(2a×1{0}^{-10})^{3}}$g•cm-3(NA为阿伏加德罗常数的值,只列计算式).该晶体中与N原子距离相等且最近的N原子有12个;
(5)科学家通过X一射线探明KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似.则KCl、CaO、TiN三种离子晶体熔点由高到低的顺序为TiN>CaO>KCl.判断依据是:离子所带的电荷数越高,晶格能越大,熔点越高.

图中的M是短周期金属元素,M的部分电离能如下表:
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/kJ•mol-1 | 738 | 1451 | 7733 | 10540 | 13630 |
(1)Ti的基态原子外围电子排布式为3d24s2;
(2)M是Mg(填元素符号),该金属晶体的堆积模型为六方最密堆积,配位数为12;
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图2所示.化合物甲的分子中采取sp2方式杂化的碳原子有7个,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺序为O>N>C;
(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图3所示,该晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为$\frac{4×62}{{N}_{A}×(2a×1{0}^{-10})^{3}}$g•cm-3(NA为阿伏加德罗常数的值,只列计算式).该晶体中与N原子距离相等且最近的N原子有12个;
(5)科学家通过X一射线探明KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似.则KCl、CaO、TiN三种离子晶体熔点由高到低的顺序为TiN>CaO>KCl.判断依据是:离子所带的电荷数越高,晶格能越大,熔点越高.
16. 氮的化合物在农业、国防工业、航天工业等领域有广泛的用途.
氮的化合物在农业、国防工业、航天工业等领域有广泛的用途.
(1)航天工业中常用N2H4做高能燃料,N2O4作氧化剂.已知N2(g)+O2(g)=2NO(g)△H=+180.7kJ•mol-1
2NO(g)+O2(g)=2NO2(g)△H=-113.0kJ•mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ•mol-1
2NO2(g)?N2O4(g)△H=-52.7kJ•mol-1
N2H4(g)和N2O4(g)反应生成一种气态的10e-分子,还有一种极稳定的单质,写出反应的热化学方程式:2N2H4(g)+N2O4(g)?3N2(g)+4H2O(g)△H=-1083.0kJ•mol-1
(2)工业合成氨对人类社会的发展意义重大,在实验室中常用N2和H2在一定条件下进行合成氨的相关研究.T℃时,向容积为3L的密闭容器中,投入4mol N2和9mol H2,10min达到化学平衡状态,平衡时NH3的物质的量为2mol,则0~10min内H2的平均速率v(H2)=0.1mol/(L.min),平衡时N2的转化率α(N2)=25%.若再增加氢气浓度,该反应的平衡常数将不变(填“增大”、“减小”或“不变”).
(3)氨水是一种常用的沉淀剂和中和剂.
①已知25℃时,几种难溶电解质的溶度积如下表所示:
向Cu2+、Mg2+、Fe3+、Fe2+浓度都为0.01mol•L-1的溶液中逐滴滴加稀氨水,产生沉淀的先后顺序为Fe(OH)3、Cu(OH)2、Fe(OH)2、Mg(OH)2(用化学式表示).
②25℃时,将amol/L的氨水与b mol/L盐酸等体积混合,反应后溶液恰好显中性,则a>b. (填“>”、“<”或“=”);用a、b表示NH3•H2O的电离平衡常数Kb=$\frac{b×1{0}^{-7}}{a-b}$.
(4)(NH4)2CO3是一种捕碳剂,其捕捉CO2的原理为:
(NH4)2CO3(aq)+H2O(l)+CO2(g) 2NH4HCO3 (aq)△H
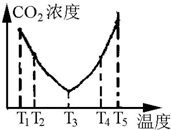
为研究温度对捕碳效率的影响,在不同温度条件下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2,在t时刻,测得容器中CO2气体的浓度.其关系如图:
①捕捉CO2反应的△H<0(填“>”、“=”或“<”).
②在T4~T5这个温度区间,容器内CO2气体浓度变化趋势的原因是:T4~T5反应达平衡,正反应为放热反应,随着温度的升高,平衡逆向移动,CO2的吸收效率降低(或NH4HCO3部分分解).
 氮的化合物在农业、国防工业、航天工业等领域有广泛的用途.
氮的化合物在农业、国防工业、航天工业等领域有广泛的用途.(1)航天工业中常用N2H4做高能燃料,N2O4作氧化剂.已知N2(g)+O2(g)=2NO(g)△H=+180.7kJ•mol-1
2NO(g)+O2(g)=2NO2(g)△H=-113.0kJ•mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ•mol-1
2NO2(g)?N2O4(g)△H=-52.7kJ•mol-1
N2H4(g)和N2O4(g)反应生成一种气态的10e-分子,还有一种极稳定的单质,写出反应的热化学方程式:2N2H4(g)+N2O4(g)?3N2(g)+4H2O(g)△H=-1083.0kJ•mol-1
(2)工业合成氨对人类社会的发展意义重大,在实验室中常用N2和H2在一定条件下进行合成氨的相关研究.T℃时,向容积为3L的密闭容器中,投入4mol N2和9mol H2,10min达到化学平衡状态,平衡时NH3的物质的量为2mol,则0~10min内H2的平均速率v(H2)=0.1mol/(L.min),平衡时N2的转化率α(N2)=25%.若再增加氢气浓度,该反应的平衡常数将不变(填“增大”、“减小”或“不变”).
(3)氨水是一种常用的沉淀剂和中和剂.
①已知25℃时,几种难溶电解质的溶度积如下表所示:
| 氢氧化物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
| Ksp | 2.2×10-20 | 4.0×10-38 | 8.0×10-16 | 1.8×10-11 |
②25℃时,将amol/L的氨水与b mol/L盐酸等体积混合,反应后溶液恰好显中性,则a>b. (填“>”、“<”或“=”);用a、b表示NH3•H2O的电离平衡常数Kb=$\frac{b×1{0}^{-7}}{a-b}$.
(4)(NH4)2CO3是一种捕碳剂,其捕捉CO2的原理为:
(NH4)2CO3(aq)+H2O(l)+CO2(g) 2NH4HCO3 (aq)△H
为研究温度对捕碳效率的影响,在不同温度条件下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2,在t时刻,测得容器中CO2气体的浓度.其关系如图:
①捕捉CO2反应的△H<0(填“>”、“=”或“<”).
②在T4~T5这个温度区间,容器内CO2气体浓度变化趋势的原因是:T4~T5反应达平衡,正反应为放热反应,随着温度的升高,平衡逆向移动,CO2的吸收效率降低(或NH4HCO3部分分解).
3.现有Na2CO3、H2SO4、Ba(OH)2三种溶液,它们的体积与物质的量浓度都相等.以不同顺序将它们中的两种混合,若产生沉淀则过滤,再将滤液与第三种溶液混合,那么最终所得的溶液( )
| A. | 可能呈酸性 | B. | 不可能呈碱性 | ||
| C. | 可能呈中性或碱性 | D. | 不可能呈中性 |
13.氯化硫(S2Cl2)的结构式为Cl-S-S-Cl,常温下为浅黄色油状液体,遇与水即分解:2S2Cl2+2H2O→4HCl+SO2↑+3S↓.下列有关此反应的说法正确的是( )
| A. | S2Cl2做氧化剂,H2O做还原剂 | |
| B. | 每生成l mol SO2转移4 mol电子 | |
| C. | 氧化产物与还原产物的物质的量之比为l:3 | |
| D. | 每生成48g硫会断裂2mol氢氧键 |
20.下列减小环境污染的方法,其原理不涉及化学变化的是( )
| A | B | C | D | |
| 污染 | 废旧热固性塑料 | 煤燃烧 | 含Hg2+的工业废水 | 生活垃圾 |
| 方法 | 粉碎作为填充剂 | 煤中加入适量石灰石 | 加入Na2S溶液 | 焚烧发电 |
| A. | A | B. | B | C. | C | D. | D |
18.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 使酚酞呈红色的溶液:Na+、NO3-、Ba2+、Br- | |
| B. | 加水稀释pH减小的溶液:K+、Al3+、Cl-、CH3COO- | |
| C. | 含有大量Fe(NO3)2的溶液:NH4+、H+、SO42-、I- | |
| D. | c(OH-)<$\sqrt{{K}_{w}}$的溶液:ClO-、NO3-、Na+、Ca2+ |