题目内容
10.甲苯和甘油组成的混合物中,若碳元素的质量分数为0.63,那么可推知氢元素的质量分数为( )| A. | 0.087 | B. | 0.174 | C. | 0.06 | D. | 无法确定 |
分析 甲苯分子式为C7H8,甘油分子式为C3H8O3,二者相对分子质量都是92,分子中H原子数目相等,则H元素的质量分数相同,混合后H元素的质量分数不变.
解答 解:甲苯分子式为C7H8,甘油分子式为C3H8O3,二者相对分子质量都是92,分子中H原子数目相等,H元素的质量分数相同,故混合物中H元素质量分数为$\frac{8}{92}$×100%=8.7%,
故选A.
点评 本题考查混合物中元素质量分数的有关计算,难度不大,关键是根据分子式的判断二者氢元素的质量分数相等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.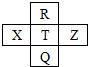 元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸,则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸,则下列判断正确的是( )
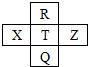 元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸,则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸,则下列判断正确的是( )| A. | 非金属性:X<T<Z | B. | 第一电离能:Z<X<T | ||
| C. | 最高价氧化物的水化物酸性:Q<T<R | D. | 气态氢化物的还原性:R<T<X |
18.下列说法正确的是( )
| A. | Li是最活泼金属,F是最活泼非金属 | |
| B. | Mg(OH)2碱性比Ca(OH)2强 | |
| C. | X2+的核外电子数目为18,则X在第三周期第ⅡA族 | |
| D. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16族 |
5.铁盐是中学化学常见的盐.下面是以富含硫酸亚铁的工业废液为原料生产氧化铁和制备草酸亚铁晶体(FeC2O3•xH2O )的工艺流程图(部分操作和条件略).

请回答下列问题:
已知:①pH>4时,Fe2+易被氧气氧化;②NH4HCO3在热水中会分解;
③几种物质的溶解度(g/l00g H2O)如下
(1)流程图步骤Ⅰ中,在提纯时需要加足量的铁屑的原因是除去废液中的2Fe3+(或Fe+2Fe3+=3Fe2+).
(2)在生产氧化铁的步骤Ⅲ中,生成FeCO3的离子方程式是Fe2++2HCO3-=FeCO3↓+CO2↑+H2O.
(3)上述流程图制备草酸亚铁过程中,用稀硫酸调溶液pH至1〜2的目的是防止亚铁离子水解,防止亚铁离子氧化趁热过滤的原因是增大杂质的溶解度(防止低温时杂质析出),影响产品的纯度.
(4)己知煅烧FeCO3的化学方程式是4FeCO3+O2═2Fe2O3+4CO2.现煅烧464.0kg的FeCO3,得到316.8kg产品.若产品中杂质只有FeO.则该产品中Fe2O3的质量是288.0kg.
(5)已知:某温度时,Ksp(FeC2O4)=1.0×10-6.Ksp(CaC2O4)=2.0×10-9,此温度下,FeC2O4若要在CaCl2溶液中开始转化为CaC2O4,则CaCl2的浓度必须不低于2.0×10-6mol•L-1.
(6)草酸(HzC2O4)是一种二元弱酸,广泛分布于动植物体中.已知0.1mol•L-1KHC2O4溶液呈酸性.下列说法正确的是ac(填字母序号)a、0.1mol•L-1KHC2O4溶液中:c(K+)+c(H+)═c(HC2O4-)+2c(C2O42-)+c(OH- )
b.0.1mol•L-1KHC2O4溶液中:c(K+)>c(HC2O4-)>c((H2C2O4)>c(C2O42-)
C.0.1mol/LKHC2O4溶液中滴加等浓度NaOH溶液至中性:c(K+)>c(Na+)
d.浓度均为0.lmol•L-1KHC2O4和K2C2O4的混合溶液中:2c(K+)═c(HC2O4-)+c(C2O42-)

请回答下列问题:
已知:①pH>4时,Fe2+易被氧气氧化;②NH4HCO3在热水中会分解;
③几种物质的溶解度(g/l00g H2O)如下
| FeS04•7H2O | (NH4)2SO4 | FeSO4•(NH4)2SO4•6H2O | |
| 20℃ | 48 | 75 | 37 |
| 60℃ | 101 | 88 | 38 |
(2)在生产氧化铁的步骤Ⅲ中,生成FeCO3的离子方程式是Fe2++2HCO3-=FeCO3↓+CO2↑+H2O.
(3)上述流程图制备草酸亚铁过程中,用稀硫酸调溶液pH至1〜2的目的是防止亚铁离子水解,防止亚铁离子氧化趁热过滤的原因是增大杂质的溶解度(防止低温时杂质析出),影响产品的纯度.
(4)己知煅烧FeCO3的化学方程式是4FeCO3+O2═2Fe2O3+4CO2.现煅烧464.0kg的FeCO3,得到316.8kg产品.若产品中杂质只有FeO.则该产品中Fe2O3的质量是288.0kg.
(5)已知:某温度时,Ksp(FeC2O4)=1.0×10-6.Ksp(CaC2O4)=2.0×10-9,此温度下,FeC2O4若要在CaCl2溶液中开始转化为CaC2O4,则CaCl2的浓度必须不低于2.0×10-6mol•L-1.
(6)草酸(HzC2O4)是一种二元弱酸,广泛分布于动植物体中.已知0.1mol•L-1KHC2O4溶液呈酸性.下列说法正确的是ac(填字母序号)a、0.1mol•L-1KHC2O4溶液中:c(K+)+c(H+)═c(HC2O4-)+2c(C2O42-)+c(OH- )
b.0.1mol•L-1KHC2O4溶液中:c(K+)>c(HC2O4-)>c((H2C2O4)>c(C2O42-)
C.0.1mol/LKHC2O4溶液中滴加等浓度NaOH溶液至中性:c(K+)>c(Na+)
d.浓度均为0.lmol•L-1KHC2O4和K2C2O4的混合溶液中:2c(K+)═c(HC2O4-)+c(C2O42-)
15.标准状况下,将NO2、NO、O2 混合并充满容器,然后把容器倒置于水槽中,充分反应后,水充满容器,则容器中HNO3溶液的物质的量的浓度(mol/L)用M表示范围是( )
| A. | $\frac{1}{28}$<M<$\frac{1}{22.4}$ | B. | $\frac{1}{39.2}$<M<$\frac{1}{22.4}$ | C. | $\frac{1}{39.2}$<M<$\frac{1}{28}$ | D. | 0<M<$\frac{1}{22.4}$ |
19.下列各表述与示意图一致的是( )
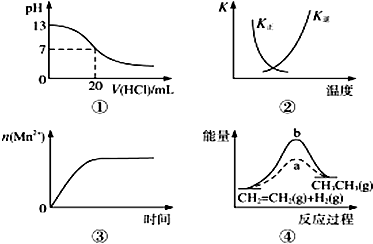

| A. | 图①表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的p随加入酸体积的变化 | |
| B. | 图②中曲线表示反应2SO2(g)+O2(g)?2SO3(g)△H<0正、逆反应的平衡常数K随温度的变化 | |
| C. | 图③表示10 mL 0.01 mol•L-1 KMnO4酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混合时,n(Mn2+)随时间的变化 | |
| D. | 图④中a、b曲线分别表示反应CH2═CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的能量变化 |
20.下列物质中互为同系物的是( )
| A. | 甲烷与丙烷 | B. | 乙醇与乙酸 | ||
| C. | 一氯甲烷与二氯甲烷 | D. | 正丁烷与异丁烷 |
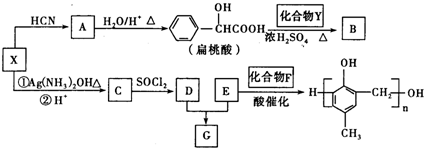
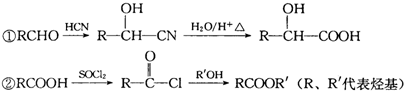
 .
.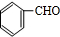 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$ +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O. +NaOH$\stackrel{△}{→}$
+NaOH$\stackrel{△}{→}$ +
+ .
.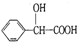 的同分异构体中:①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应;④含氧官能团处在对位.满足上述条件的同分异构体共有3种(不考虑立体异构),写出核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式
的同分异构体中:①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应;④含氧官能团处在对位.满足上述条件的同分异构体共有3种(不考虑立体异构),写出核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式 .
.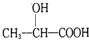 )的路线(其它试剂任选).
)的路线(其它试剂任选). B…$→_{反应条件}^{反应试剂}$目标产物)
B…$→_{反应条件}^{反应试剂}$目标产物)