题目内容
5.下列叙述中正确的是( )| A. | 以Al作阳极,Fe作阴极,可以实现铁上镀铝 | |
| B. | 向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体的原理是加热促进了Fe3+水解 | |
| C. | 向纯水中加入盐酸或降温,都能使水的电离平衡逆向移动,水的离子积减小 | |
| D. | 3C(s)+CaO(s)═CaC2(s)+CO(g)在常温下不能自发进行,说明该反应的△H>0 |
分析 A、铝离子在水溶液中不易得电子;
B、加热促进了的Fe3+水解;
C、水的离子积大小和温度有关,酸碱会抑制水的电离;
D、根据反应自发进行的判据△H-T△S<0结合反应情况来回答.
解答 解:A、在水溶液中铝离子在氢离子后放电,不能析出铝,故A错误;
B、向沸水中滴加FeCl3饱和溶液制各Fe(OH)3胶体的原因是加热促进的Fe3+水解,故B正确;
C、向纯水中加入盐酸会抑制水的电离,但是离子积不变,降温都能使水的离子积减小,故C错误;
D、反应的熵变是正值,在常温下不能自发进行,根据判据△H-T△S<0,所以该反应的△H>0,故D正确.
故选BD.
点评 本题考查水的电离平衡、胶体的制备、反应的自发性和电解原理的应用知识,难度不大,注意知识的迁移应用是关键,难度中等.

练习册系列答案
相关题目
12.X、Y、Z、M、N是元素周期表中的短周期主族元素,且原子序数依次递增.已知X的最外层电子数是次外层电子数的3倍,X、M同主族,Y在同周期主族元素中原子半径最大,Z的最高化合价与最低化合价的代数和为零.下列说法正确的是( )
| A. | 单质的氧化性:X<M | |
| B. | 气态氢化物的热稳定性:M>N | |
| C. | X与Y简单离子半径:r(X离子)<r(Y离子) | |
| D. | 化合物ZX2与ZN4含有相同类型的化学键 |
20.设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
| A. | 标准状况下,2.24 L Cl2与足量的稀NaOH溶液反应,转移电子总数为0.2 NA | |
| B. | 欲配制1.00 L 1.00 mol•L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中 | |
| C. | 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 | |
| D. | 标准状况下,0.1NA的SO3的体积约为2.24 L |
10.一定体积0.01mol•L-1的稀硝酸恰好能氧化一定质量的铁、铝混合物.已知两种金属均被氧化为最高价态,还原产物只有NO.若用0.01mol•L-1NaOH溶液溶解相同质量的该混合物,当反应完全时所需氢氧化钠溶液的体积是稀硝酸的五分之一,则样品中铁、铝的物质的量之比为( )
| A. | 2:3 | B. | 1:3 | C. | 1:4 | D. | 5:3 |
17.四个体积相同的密闭容器,在一定条件下,发生如下反应:N2+3H2$?_{催化剂}^{高温、高压}$2NH3,化学反应速率最快的是( )
| 容器 | 温度(℃) | H2(mol) | N2(mol) | 催化剂 |
| A | 450 | 3 | 1 | 无 |
| B | 450 | 3 | 1 | 有 |
| C | 500 | 6 | 2 | 有 |
| D | 500 | 6 | 2 | 无 |
| A. | A | B. | B | C. | C | D. | D |
15.下列实验现象预测正确的是( )
| A. | 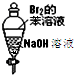 振荡后静置,溶液不再分层,且保持无色透明 | |
| B. |  铁片最终完全溶解,且高锰酸钾溶液变无色 | |
| C. |  微热稀HNO3片刻,溶液中有气泡产生,广口瓶内出现红棕色气体 | |
| D. |  当溶液至红褐色,停止加热,液体变为黄色 |

 .
.