题目内容
13.不同的卤素原子之间可化合形成一系列化合物,这类化合物叫做卤素互化物.现将3.73gBrClm溶于水后,通入足量的SO2气体与其反应生成氢溴酸、盐酸和硫酸,再用碱将溶液调至中性后加入过量Ba(NO3)2,充分反应后滤去沉淀物,再向滤液中加入过量的AgNO3溶液,最后得到卤化银沉淀12.37g.(1)计算参加反应的AgNO3的物质的量为0.08mol;
(2)BrClm中的m=3.
(3)被氧化的SO2气体体积为3.584L(标准状况下)
分析 氢溴酸、盐酸和硫酸混合溶液用碱将溶液调至中性后加入过量Ba(NO3)2,硫酸根转化为硫酸钡沉淀,充分反应后滤去沉淀物,再向滤液中加入过量的AgNO3溶液,最后得到卤化银沉淀12.37g为AgBr、AgCl,根据质量守恒可知,Ag元素的质量为12.37g-3.73g=8.64g,故其物质的量为0.08mol,根据Ag元素守恒计算参加反应的AgNO3的物质的量,由Ag守恒可知AgBr、AgCl总物质的量为0.08mol,结合二者总质量列方程计算各自物质的量,根据原子守恒计算BrClm中m的值.
解答 解:氢溴酸、盐酸和硫酸混合溶液用碱将溶液调至中性后加入过量Ba(NO3)2,硫酸根转化为硫酸钡沉淀,充分反应后滤去沉淀物,再向滤液中加入过量的AgNO3溶液,最后得到卤化银沉淀12.37g为AgBr、AgCl,根据质量守恒可知,Ag元素的质量为12.37g-3.73g=8.64g,故其物质的量为$\frac{8.64g}{108g/mol}$=0.08mol,根据Ag元素守恒,参加反应n(AgNO3)=n(Ag元素)=0.08mol,
由Ag守恒可知AgBr、AgCl总物质的量为0.08mol,设AgBr、AgCl的物质的量分别为a mol、b mol,则:
$\left\{\begin{array}{l}{a+b=0.08}\\{188a+143.5b=12.37}\end{array}\right.$
解得a=0.02,b=0.06,
根据Br元素守恒,n(BrClm)=n(AgBr)=0.08mol,
根据Cl元素守恒,则0.02mol×m=0.06mol,故m=3,而SO2和BrCl3反应的方程式为:
2SO2 +BrCl3 +4H2O=2H2SO4 +HBr+3HCl,
2×22.4L 1mol
V 0.08mol
$\frac{2×22.4L}{V}=\frac{1mol}{0.08mol}$,所以V=3.584L
答:(1)计算参加反应的AgNO3的物质的量为0.08mol;
(2)BrClm中m的值为3;
(3)被氧化的SO2气体体积为3.584L.
点评 本题考查混合物计算,注意利用质量守恒定律确定卤化银中Ag元素质量,再利用元素守恒计算计算解答,难度中等,侧重考查学生的分析计算能力.

| A. | 航天服主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它属于新型无机非金属材料 | |
| B. | 补血口服液中添加维生素C,作为氧化剂 | |
| C. | 用CO2合成聚碳酸酯可降解塑料,可以实现“碳”的循环利用 | |
| D. | 国务院要求坚决控制钢铁、水泥、焦炭等行业落后产能总量,是落实“低碳经济”的具体举措 |
| A. | Na2O和Na2O2都能与水反应生成NaOH,所以他们是碱性氧化物 | |
| B. | 向饱和Na2CO3溶液中通入足量CO2,反应的离子方程式为CO32-+CO2+H2O═2HCO32- | |
| C. | NaCl可作为工业冶炼钠的原料,冶炼应在无水条件下进行 | |
| D. | 固体NaOH的潮解和Na2CO3•10H2O的风化均为物理变化 |

| A. | ①② | B. | ③④ | C. | ②③ | D. | ②④ |
| A. | 以Al作阳极,Fe作阴极,可以实现铁上镀铝 | |
| B. | 向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体的原理是加热促进了Fe3+水解 | |
| C. | 向纯水中加入盐酸或降温,都能使水的电离平衡逆向移动,水的离子积减小 | |
| D. | 3C(s)+CaO(s)═CaC2(s)+CO(g)在常温下不能自发进行,说明该反应的△H>0 |
| A. | C2H5OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOC2H5+H2O | |
| B. | H-C≡C-H+HCl$\stackrel{催化剂}{→}$H2C=CHCl | |
| C. | 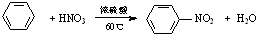 | |
| D. |  |
