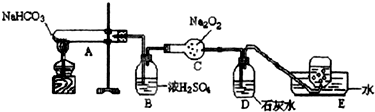
题目内容
17.四个体积相同的密闭容器,在一定条件下,发生如下反应:N2+3H2$?_{催化剂}^{高温、高压}$2NH3,化学反应速率最快的是( )| 容器 | 温度(℃) | H2(mol) | N2(mol) | 催化剂 |
| A | 450 | 3 | 1 | 无 |
| B | 450 | 3 | 1 | 有 |
| C | 500 | 6 | 2 | 有 |
| D | 500 | 6 | 2 | 无 |
| A. | A | B. | B | C. | C | D. | D |
分析 温度越高化学反应速率越快,浓度越大化学反应速率越快,使用催化剂可以加快化学反应速率,以此分析.
解答 解:由表格中的数据可知,500℃是最高温度,6mol氢气和2mol氮气所在容器中的浓度最大,使用催化剂可以加快化学反应速率,容器C中温度最高、浓度最大、使用了催化剂,因此化学反应速率最快的是容器C,
故选C.
点评 本题考查了外界条件对化学反应速率的影响,难度不大,掌握好外界条件对化学反应速率是如何影响的是解题的关键,注意加强化学反应原理的理解和应用.

练习册系列答案
 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
5.下列叙述中正确的是( )
| A. | 以Al作阳极,Fe作阴极,可以实现铁上镀铝 | |
| B. | 向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体的原理是加热促进了Fe3+水解 | |
| C. | 向纯水中加入盐酸或降温,都能使水的电离平衡逆向移动,水的离子积减小 | |
| D. | 3C(s)+CaO(s)═CaC2(s)+CO(g)在常温下不能自发进行,说明该反应的△H>0 |
2. 某研究小组将纯净的SO2气体通入0.1mol•L?1的Ba(NO3)2溶液中,得到了BaSO4沉淀,为探究上述溶液中何种微粒能氧化通入的SO2,该小组进行了如下假设:
某研究小组将纯净的SO2气体通入0.1mol•L?1的Ba(NO3)2溶液中,得到了BaSO4沉淀,为探究上述溶液中何种微粒能氧化通入的SO2,该小组进行了如下假设:
假设一:溶液中的NO3-
假设二:溶液中溶解的O2
(1)验证假设一
该小组设计实验验证假设一,请在下表空白处填写相关实验现象
(2)为深入研究该反应,该小组还测得上述两个实验中溶液的pH随通入SO2体积的变化曲线入如图,实验1中溶液pH变小的原因是SO2溶于水后生成H2SO3;V1时,实验2中溶液pH小于实验1的原因是(用离子方程式表示)3SO2+2NO3-+2H2O=3SO42-+4H++2NO.
(3)验证假设二:请设计实验验证假设二,写出实验步骤,预期现象和结论(不要求写具体操作过程).
 某研究小组将纯净的SO2气体通入0.1mol•L?1的Ba(NO3)2溶液中,得到了BaSO4沉淀,为探究上述溶液中何种微粒能氧化通入的SO2,该小组进行了如下假设:
某研究小组将纯净的SO2气体通入0.1mol•L?1的Ba(NO3)2溶液中,得到了BaSO4沉淀,为探究上述溶液中何种微粒能氧化通入的SO2,该小组进行了如下假设:假设一:溶液中的NO3-
假设二:溶液中溶解的O2
(1)验证假设一
该小组设计实验验证假设一,请在下表空白处填写相关实验现象
| 实验步骤 | 实验现象 | 结论 |
| 实验1:在盛有不含O2的25ml0.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | 假设一成立 | |
| 实验2:在盛有不含O2的25ml0.1mol/LBa(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 |
(3)验证假设二:请设计实验验证假设二,写出实验步骤,预期现象和结论(不要求写具体操作过程).
| 实验步骤 | 实验现象 | 结论 |
| 假设二成立 | ||
6.下列有机反应不属于取代反应的是( )
| A. | C2H5OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOC2H5+H2O | |
| B. | H-C≡C-H+HCl$\stackrel{催化剂}{→}$H2C=CHCl | |
| C. | 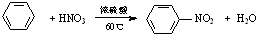 | |
| D. |  |
7.2015年8月12日晚11时许,天津市塘沽开发区一带发生爆炸事故,现场火光冲天.据多位市民反映,事发时十公里范围内均有震感,抬头可见蘑菇云,安全问题再次敲响了警钟.下列关于安全问题的说法不正确的是( )
| A. | 危险化学品包括:爆炸品、易燃物质、自燃自热物质、氧化性物质、剧毒物质、加压气体等 | |
| B. | 金属钠着火不能用水灭火,应使用干砂灭火 | |
| C. | 处置实验过程中产生的有毒药品废液时,应用大量水稀释后才能排入下水道 | |
| D. | 简单辨认有味的化学药品时,将瓶口远离鼻子,用手在瓶口上方扇动,稍闻其味即可 |