题目内容
14.写出NaHS溶液中的三个守恒:a、电荷守恒:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-);
b、物料守恒:c(Na+)=c(S2-)+c(HS-)+c(H2S);
c、质子守恒:c(OH-)+c(S2-)=c(H+)+c(H2S).
分析 任何溶液中都满足电荷守恒、物料守恒和质子守恒,NaHS溶液中存在的三个守恒分别为:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-)、c(Na+)=c(S2-)+c(HS-)+c(H2S)、c(OH-)+c(S2-)=c(H+)+c(H2S).
解答 解:NaHS为强碱弱酸盐,HS-水解导致溶液呈碱性,溶液中总正电荷浓度一定与总负电荷浓度相等,即满足电荷守恒:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-);
存在的物料守恒为:c(Na+)=c(S2-)+c(HS-)+c(H2S);
存在的质子守恒为:c(OH-)+c(S2-)=c(H+)+c(H2S),
故答案为:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-);c(Na+)=c(S2-)+c(HS-)+c(H2S);c(OH-)+c(S2-)=c(H+)+c(H2S).
点评 本题考查了离子浓度大小比较,题目难度不大,明确电荷守恒、物料守恒及质子守恒的含义为解答关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
1.有关钠的化合物的说法正确的是( )
| A. | Na2O和Na2O2都能与水反应生成NaOH,所以他们是碱性氧化物 | |
| B. | 向饱和Na2CO3溶液中通入足量CO2,反应的离子方程式为CO32-+CO2+H2O═2HCO32- | |
| C. | NaCl可作为工业冶炼钠的原料,冶炼应在无水条件下进行 | |
| D. | 固体NaOH的潮解和Na2CO3•10H2O的风化均为物理变化 |
5.下列叙述中正确的是( )
| A. | 以Al作阳极,Fe作阴极,可以实现铁上镀铝 | |
| B. | 向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体的原理是加热促进了Fe3+水解 | |
| C. | 向纯水中加入盐酸或降温,都能使水的电离平衡逆向移动,水的离子积减小 | |
| D. | 3C(s)+CaO(s)═CaC2(s)+CO(g)在常温下不能自发进行,说明该反应的△H>0 |
2. 某研究小组将纯净的SO2气体通入0.1mol•L?1的Ba(NO3)2溶液中,得到了BaSO4沉淀,为探究上述溶液中何种微粒能氧化通入的SO2,该小组进行了如下假设:
某研究小组将纯净的SO2气体通入0.1mol•L?1的Ba(NO3)2溶液中,得到了BaSO4沉淀,为探究上述溶液中何种微粒能氧化通入的SO2,该小组进行了如下假设:
假设一:溶液中的NO3-
假设二:溶液中溶解的O2
(1)验证假设一
该小组设计实验验证假设一,请在下表空白处填写相关实验现象
(2)为深入研究该反应,该小组还测得上述两个实验中溶液的pH随通入SO2体积的变化曲线入如图,实验1中溶液pH变小的原因是SO2溶于水后生成H2SO3;V1时,实验2中溶液pH小于实验1的原因是(用离子方程式表示)3SO2+2NO3-+2H2O=3SO42-+4H++2NO.
(3)验证假设二:请设计实验验证假设二,写出实验步骤,预期现象和结论(不要求写具体操作过程).
 某研究小组将纯净的SO2气体通入0.1mol•L?1的Ba(NO3)2溶液中,得到了BaSO4沉淀,为探究上述溶液中何种微粒能氧化通入的SO2,该小组进行了如下假设:
某研究小组将纯净的SO2气体通入0.1mol•L?1的Ba(NO3)2溶液中,得到了BaSO4沉淀,为探究上述溶液中何种微粒能氧化通入的SO2,该小组进行了如下假设:假设一:溶液中的NO3-
假设二:溶液中溶解的O2
(1)验证假设一
该小组设计实验验证假设一,请在下表空白处填写相关实验现象
| 实验步骤 | 实验现象 | 结论 |
| 实验1:在盛有不含O2的25ml0.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | 假设一成立 | |
| 实验2:在盛有不含O2的25ml0.1mol/LBa(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 |
(3)验证假设二:请设计实验验证假设二,写出实验步骤,预期现象和结论(不要求写具体操作过程).
| 实验步骤 | 实验现象 | 结论 |
| 假设二成立 | ||
19.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | pH=1的溶液中:Ca2+、Fe2+、NO3-、CO32- | |
| B. | $\frac{{K}_{W}}{c(O{H}^{-})}$=0.1 mol•L-1的溶液中:Na+、NH4+、Cl-、NO3- | |
| C. | c(Fe3+)=0.1 mol•L-1的溶液中:K+、SCN-、SO42-、Cl- | |
| D. | 由水电离的c(H+)=1×10-14 mol•L-1的溶液中:Na+、AlO2-、HCO3-、OH- |
6.下列有机反应不属于取代反应的是( )
| A. | C2H5OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOC2H5+H2O | |
| B. | H-C≡C-H+HCl$\stackrel{催化剂}{→}$H2C=CHCl | |
| C. | 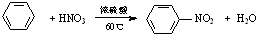 | |
| D. |  |
3.下列表达正确的是( )
| A. | 溶液中可大量共存:Mg2+、HCO32-、SO42-、OH- | |
| B. | 新制的饱和氯水中可大量共存:Na+、CO32-、SO32-、 | |
| C. | 醋酸除水垢:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| D. | 用惰性电极电解熔融氯化钠:2Cl-+2Na+$\frac{\underline{\;通电\;}}{\;}$2Na+Cl2↑ |
4.碘在不同状态下(固态或气态)与氢气反应的热化学方程式如下所示:
①H2(g)+I2(?)═2HI(g);△H=+9.48kJ/mol
②H2(g)+I2(?)═2HI(g);△H=-26.48kJ/mol
下列判断正确的是( )
①H2(g)+I2(?)═2HI(g);△H=+9.48kJ/mol
②H2(g)+I2(?)═2HI(g);△H=-26.48kJ/mol
下列判断正确的是( )
| A. | ①中的I2为固态,②中的I2为气态 | |
| B. | ②的反应物总能量比①的反应物总能量低 | |
| C. | ①的产物比②的产物热稳定性更好 | |
| D. | 1 mol固态碘升华时将吸热17 kJ |