题目内容
11.下列溶液中Cl-浓度与50mL 1mol•L-1 AlCl3溶液中Cl-的物质的量浓度相等的是( )| A. | 150 mL 1 mol•L-1的NaCl溶液 | B. | 75 mL 2 mol•L-1 NH4Cl溶液 | ||
| C. | 150 mL 3 mol•L-1的KCl溶液 | D. | 75 mL 3 mol•L-1的FeCl3溶液 |
分析 氯离子的物质的量浓度与溶液体积大小无关,与溶质化学式及物质的量浓度有关,如:50mL 1mol•L-1 AlCl3溶液中Cl-的物质的量浓度为:1mol/L×3=3mol/L,据此对各选项进行计算.
解答 解:50mL 1mol•L-1 AlCl3溶液中Cl-的物质的量浓度为:1mol/L×3=3mol/L,
A.150 mL 1 mol•L-1的NaCl溶液中硫离子的浓度为1mol/L,故A错误;
B.75 mL 2 mol•L-1 NH4Cl溶液中氯离子浓度为2mol/L,故B错误;
C.150 mL 3 mol•L-1的KCl溶液中氯离子的物质的量浓度为3mol/L,故C正确;
D.75mL 3 mol•L-1的FeCl3溶液中氯离子的物质的量浓度为:3mol/L×3=9mol/L,故D错误;
故选C.
点评 本题考查了物质的量浓度的计算,题目难度不大,注意物质的量浓度与溶液体积大小无关,为易错点,注意掌握物质的量浓度的概念及表达式,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
1.苯分子中六个碳-碳键是完全等同的,不是单双键交替结构,下列事实不能证明这一结论的是( )
| A. | 苯不能使酸性高锰酸钾溶液褪色 | B. | 苯的一氯代物只有一种 | ||
| C. | 苯的二氯代物只有三种 | D. | 苯分子中六个碳碳键键长完全相等 |
2.下列实验装置、试剂选用或操作正确的是( )
| A. | 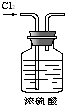 干燥Cl2 | B. | 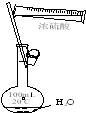 称量NaOH | C. | 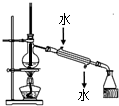 稀释浓硫酸 | D. | 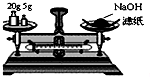 制取蒸馏水 |
19.下列说法中正确的是( )
| A. | 100 mL pH=3的盐酸和醋酸溶液,与足量锌反应时,起始时二者产生氢气的速率基本相等 | |
| B. | 100 mL 1 mol•L-1的盐酸和50 mL 2 mol•L-1的盐酸分别与足量的锌反应,两者放出氢气的速率和质量均相等 | |
| C. | 100 mL pH=3的盐酸和醋酸溶液,与足量锌反应后,所得氢气的质量相等. | |
| D. | 100 mL 0.1mol•L-1的硫酸和盐酸溶液,与足量锌反应后,前者放出氢气的质量是后者放出氢气质量的$\frac{1}{2}$ |
6.一定温度下,在容积恒定的密闭容器中,进行如下可逆反应:A(s)+2B(g)?C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是①混合气体的密度 ②容器内气体的压强 ③混合气体的总物质的量 ④B物质的量浓度( )
| A. | ①④ | B. | ②③ | C. | ②③④ | D. | 只有④ |
16.下列有关说法错误的是( )
| A. | X-衍射实验可以区分晶体和非晶体 | B. | SiO2属于原子晶体 | ||
| C. | 金属钋是简单立方堆积 | D. | 晶格能的大小只与离子半径有关 |
14.在一定温度下,在固定体积的密闭容器中发生反应:N2+3H2?2NH3.该可逆反应达到化学平衡的标志是
( )
( )
| A. | 3v(H2)正=2v(NH3)逆 | |
| B. | a molN-N键断裂的同时,有6a mol N-H键断裂 | |
| C. | 混合气体的密度不再随时间变化 | |
| D. | 单位时间生成m mol N2的同时消耗3m mol H2 |
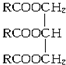 (R中不含有三键).0.1mol A与溶有96g Br2的四氯化碳溶液恰好完全反应.0.1mol A完全燃烧时生成的CO2和H2O的物质的量之和为 10.6mol.求油脂A的结构简式,写出油脂A完全氢化的化学方程式.
(R中不含有三键).0.1mol A与溶有96g Br2的四氯化碳溶液恰好完全反应.0.1mol A完全燃烧时生成的CO2和H2O的物质的量之和为 10.6mol.求油脂A的结构简式,写出油脂A完全氢化的化学方程式.