题目内容
13.下列说法正确的是( )| A. | SO2和Cl2使品红溶液褪色的原理相同 | |
| B. | 浓硫酸分别使胆矾变白、蔗糖变黑时,浓硫酸表现的性质相同 | |
| C. | 浓硝酸和浓硫酸露置在空气中,浓度都降低的原因相同 | |
| D. | 浓硫酸与稀硫酸都能与金属锌反应放出气体,两个反应的氧化产物相同 |
分析 A.氯气的漂白作用是氯气和水反应生成的次氯酸的漂白作用,二氧化硫的漂白作用是二氧化硫与水生成的亚硫酸和有色物质结合为不稳定的无色物质;
B.浓硫酸具有强氧化性,能够使蔗糖脱水生成碳,浓硫酸具有吸水性,能够吸收晶体中的结晶水;
C.浓硝酸易挥发,浓硫酸具有吸水性;
D.浓硫酸和锌发生氧化还原反应生成硫酸锌、二氧化硫和水,稀硫酸和锌反应生成硫酸锌和氢气,元素化合价升高失电子发生氧化反应;
解答 解:A.氯气的漂白作用是氯气和水反应生成的次氯酸的漂白作用,是次氯酸的强氧化性的体现;二氧化硫的漂白作用是二氧化硫与水生成的亚硫酸和有色物质结合为不稳定的无色物质,加热会恢复原来的颜色,褪色原理不同,故A错误;
B.蔗糖变黑时能够使蔗糖脱水生成碳,表现的是脱水性,胆矾遇浓硫酸变白色,体现浓硫酸的吸水性,浓硫酸表示的性质不同,故B错误;
C.浓硝酸易挥发出硝酸分子,溶液浓度减小,浓硫酸是难挥发性的酸具有吸水性使你的减小,浓硝酸和浓硫酸露置在空气中,浓度都降低的原因不相同,故C错误;
D.浓硫酸和锌发生氧化还原反应生成硫酸锌、二氧化硫和水,稀硫酸和锌反应生成硫酸锌和氢气,元素化合价升高失电子发生氧化反应D正确,氧化产物为硫酸锌,故D正确;
故选D.
点评 本题考查了硫酸、硝酸、二氧化硫和氯气性质的分析,主要是物质性质的理解应用,掌握基础是解题关键,题目难度不大.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案
相关题目
4.当光束通过下列分散系时,可能产生丁达尔效应的是( )
| A. | NaCl溶液 | B. | Fe(OH)3胶体 | C. | 盐酸 | D. | 石灰乳 |
1.苯分子中六个碳-碳键是完全等同的,不是单双键交替结构,下列事实不能证明这一结论的是( )
| A. | 苯不能使酸性高锰酸钾溶液褪色 | B. | 苯的一氯代物只有一种 | ||
| C. | 苯的二氯代物只有三种 | D. | 苯分子中六个碳碳键键长完全相等 |
8.一定条件下在密闭容器中能表示可逆反应2SO2+O2?2SO3一定达到平衡状态的是( )
①消耗2mol SO2的同时生成2mol SO3
②SO2、O2与SO3的物质的量之比为2:1:2
③反应混合物中SO3的百分含量不再改变.
①消耗2mol SO2的同时生成2mol SO3
②SO2、O2与SO3的物质的量之比为2:1:2
③反应混合物中SO3的百分含量不再改变.
| A. | ①② | B. | ②③ | C. | 只有③ | D. | 只有① |
18.铁在工业和生活中都具有非常重要的应用.某含铁化合物W,为探究其成分,化学兴趣小组的同学取化合物W粉末进行试验.经组成分析,该粉末除Fe外还有O和另一未知元素共三种元素.另取2.22g化合物W的粉末溶于适量稀硫酸,向反应后的溶液中加入含有3.20gNaOH的溶液,恰好完全反应.过滤,将洗涤后的沉淀充分灼烧,得到红棕色粉末1.60g;将所得滤液在一定条件下蒸发灼烧可得到一种纯净的不含结晶水的盐7.10g.请回答:
(1)则另一未知元素为Na(填化学式).
(2)①该化合物W的化学式为NaFeO2.
②该化合物W与适量稀硫酸反应的化学方程式2NaFeO2+4H2SO4=Na2SO4+Fe2(SO4)3+4H2O.
(3)草酸钴是广泛应用于磁性材料、电池材料、及超硬材料等领域.某研究小组在实验室探究CoC2O4分解反应的平衡常数.将一定量纯净的CoC2O4粉末置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解的平衡:CoC2O4(s)?CoO(s)+CO(g)+CO2(g),实验测得不同温度下的平衡数据列于下表:
由表中数据,列式计算250℃时CoC2O4分解平衡常数2.89×10-6.该反应的焓变△H>0(填“>”、“=”或“<”).
(4)温度加热至350℃,CO2的体积分数开始发生变化,体积分数和温度的关系如下:
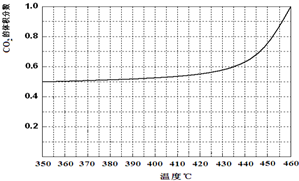
试画出CO的体积分数随温度变化的曲线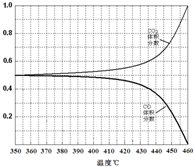 .
.
(1)则另一未知元素为Na(填化学式).
(2)①该化合物W的化学式为NaFeO2.
②该化合物W与适量稀硫酸反应的化学方程式2NaFeO2+4H2SO4=Na2SO4+Fe2(SO4)3+4H2O.
(3)草酸钴是广泛应用于磁性材料、电池材料、及超硬材料等领域.某研究小组在实验室探究CoC2O4分解反应的平衡常数.将一定量纯净的CoC2O4粉末置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解的平衡:CoC2O4(s)?CoO(s)+CO(g)+CO2(g),实验测得不同温度下的平衡数据列于下表:
| 温度(℃) | 240 | 250 | 260 | 270 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 |
| 平衡气体总浓度/ mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 |
(4)温度加热至350℃,CO2的体积分数开始发生变化,体积分数和温度的关系如下:

试画出CO的体积分数随温度变化的曲线
 .
.
2.下列实验装置、试剂选用或操作正确的是( )
| A. |  干燥Cl2 | B. |  称量NaOH | C. |  稀释浓硫酸 | D. |  制取蒸馏水 |
 HCl
HCl .
.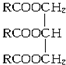 (R中不含有三键).0.1mol A与溶有96g Br2的四氯化碳溶液恰好完全反应.0.1mol A完全燃烧时生成的CO2和H2O的物质的量之和为 10.6mol.求油脂A的结构简式,写出油脂A完全氢化的化学方程式.
(R中不含有三键).0.1mol A与溶有96g Br2的四氯化碳溶液恰好完全反应.0.1mol A完全燃烧时生成的CO2和H2O的物质的量之和为 10.6mol.求油脂A的结构简式,写出油脂A完全氢化的化学方程式.