题目内容
8.雾霾严重影响人们的生活与健康.某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Fe3+、SO42-、NO3-、CO32-、Cl-,某同学收集了该地区的雾霾,经必要的预处理后获得试样溶液,设计并完成了如下的实验: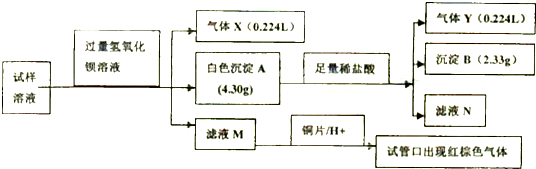
回答下列问题:
(1)气体X是NH3(图中气体体积都己换算成标准状况).
(2)沉淀BBaSO4,在沉淀A中加入足量稀盐酸后,溶解的沉淀是BaCO3.
(3)试样中肯定不存在的离子是Mg2+、Fe3+,不能确定是否存在的离子是Cl-.
(4)滤液M在酸性条件下与铜片的反应中,还原产物是NO.
(5)将实验中得到的气体Y全部通入10mL1.2mol•L-1的氢氧化钠溶液中,所得溶液中含有阴离子主要有HCO3-、CO32-.
分析 加入氢氧化钡,生成气体,说明含有NH4+,n(NH3)=$\frac{0.224L}{22.4L/mol}$=0.01mol,生成沉淀4.88g,加入盐酸剩余沉淀2.33g,为硫酸钡,且生成0.224L气体,应为二氧化碳,则n(BaSO4)=$\frac{2.33g}{233g/mol}$=0.01mol,n(BaCO3)=n(CO2)=$\frac{0.224L}{22.4L/mol}$=0.01mol,则一定存在NH4+、SO42-、CO32-,则不存在Mg2+、Fe3+,由电荷守恒可知含有Na+,滤液加入酸,且加入铜片生成气体变为红棕色,说明含有NO3-,以此解答该题.
解答 解:加入氢氧化钡,生成气体,说明含有NH4+,n(NH3)=$\frac{0.224L}{22.4L/mol}$=0.01mol,生成沉淀4.88g,加入盐酸剩余沉淀2.33g,为硫酸钡,且生成0.224L气体,应为二氧化碳,则n(BaSO4)=$\frac{2.33g}{233g/mol}$=0.01mol,n(BaCO3)=n(CO2)=$\frac{0.224L}{22.4L/mol}$=0.01mol,则一定存在NH4+、SO42-、CO32-,则不存在Mg2+、Fe3+,由电荷守恒可知含有Na+,滤液加入酸,且加入铜片生成气体变为红棕色,说明含有NO3-,
(1)由以上分析可知X为NH3,故答案为:NH3;
(2)沉淀B为BaSO4,在沉淀A中加入足量稀盐酸后,溶解的沉淀是BaCO3,故答案为:BaSO4;BaCO3;
(3)因存在CO32-,则一定不存在Mg2+、Fe3+,因Na+的物质的量不能确定,从电荷守恒的角度不能确定是否存在Cl-,则故答案为:Mg2+、Fe3+;Cl-;
(4)滤液M在酸性条件下与铜片的反应中,生成的气体在试管口被氧化生成红棕色的二氧化氮,则生成NO,故答案为:NO;
(5)n(CO2)=$\frac{0.224L}{22.4L/mol}$=0.01mol,n(NaOH)=1.2mol/L×0.01L=0.012mol,首先发生CO2+2NaOH=Na2CO3+H2O,然后发生CO2+Na2CO3+H2O=2NaHNa2CO3,反应后溶液中才能在的阴离子为HCO3-、CO32-,
故答案为:HCO3-、CO32-.
点评 本题考查较为综合,涉及物质的检验,侧重于学生的分析能力和计算能力的考查,注意把握反应的现象,结合反应的现象推断,难度中等.

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案| A. | 标准状况下,4.48 L乙醇中含有的分子数目为0.2NA | |
| B. | 常温常压下,6.4 g SO2中含有的氧原子数目为0.2NA | |
| C. | 1 L 0.1 mol•L-1 K2CO3溶液中含有的钾离子数目为0.1 NA | |
| D. | 100 mL 1.0 mol•L-1 FeCl3溶液与足量铜反应,转移的电子数目为0.2NA |
| A. | 将某有机物通入酸性高锰酸钾溶液中,溶液褪色,则该有机物一定是不饱和烃 | |
| B. | 向甲苯和乙醇中分别加入少量水,振荡后分层的是甲苯 | |
| C. | 向乙苯和苯中分别滴加溴水,溶液褪色的是乙苯 | |
| D. | 向溴乙烷和己烷中滴加硝酸银溶液,产生浅黄色沉淀的是溴乙烷 |
| A. | 16gCH4含有共价键数为4NA | |
| B. | 1mol甲基中含有电子数为10NA | |
| C. | 7.1g氯气与足量NaOH溶液反应转移的电子数为0.2NA | |
| D. | 1molC3H8分子中共价键总数为8NA |
| A. | 煤 | B. | 天然气 | C. | 汽油 | D. | 氢气 |
| A. | R有多种氧化物 | B. | R的气态氢化物很稳定 | ||
| C. | R的非金属性比Cl的非金属性强 | D. | R的最高价氧化物的水化物是强碱 |
| A. | X 能形成化学式为X(OH)3的物质 | |
| B. | X 可能形成化学式为KXO3的物质 | |
| C. | X 原子的最外层电子数一定比核电荷数少10 | |
| D. | X 可能形成化学式为KX 的物质物质 |
 如果1mol金属R的质量为a g,密度ρ=0.97g•cm-3,请计算出每个R原子的半径的表达式(设钠为紧密堆积结构,见图).
如果1mol金属R的质量为a g,密度ρ=0.97g•cm-3,请计算出每个R原子的半径的表达式(设钠为紧密堆积结构,见图).