题目内容
20.等体积、等物质的量浓度的盐酸和醋酸比较,下列说法错误的是( )| A. | 溶液中pH醋酸比盐酸大 | |
| B. | 与足量的锌粉反应产生的氢气体积相同 | |
| C. | 与足量锌粒反应时,一开始盐酸的速率快 | |
| D. | 能中和NaOH溶液的物质的量醋酸较少 |
分析 A.氢离子浓度越大,则溶液的pH越大,醋酸为弱酸,其溶液中氢离子浓度较小;
B.等体积、等浓度时含有溶质的物质的量相等,则生成氢气的量相等;
C.氢离子浓度越大,则与锌反应的速率越大;
D.溶质的物质的量相等,则中和氢氧化钠的物质的量相等.
解答 解:A.醋酸为弱酸,盐酸为强酸,则浓度相等时盐酸中氢离子浓度大于醋酸,所以醋酸溶液的pH大于盐酸,故A正确;
B.根据n=cV可知,等体积、等浓度的盐酸和醋酸中含有溶质的物质的量相等,则与锌反应生成氢气的物质的量相等,相同条件下生成氢气的体积相等,故B正确;
C.由于盐酸中氢离子浓度较大,则开始时盐酸与锌反应的速率较大,故C正确;
D.两溶液中含有HCl和醋酸的物质的量相等,都是一元酸,则中和氢氧化钠的物质的量相等,故D错误;
故选D.
点评 本题考查了弱电解质的电离平衡及其影响,题目难度中等,明确弱电解质的电离平衡特点及影响反应速率的因素为解答关键,注意掌握溶液酸碱性与溶液pH的关系.

练习册系列答案
相关题目
10.向一定量的Cu、Fe2O3的混合物中加入100mL 1mol•L-1的盐酸,恰好使混合物完全溶解,所得溶液中不含
Fe3+,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为( )
Fe3+,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为( )
| A. | 0.8g | B. | 1.6g | C. | 2.4g | D. | 3.2g |
11.根据表提供的数据,下列判断正确的是( )
| 弱酸的化学式 | CH3COOH | HClO | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 3.0×10-8 | Ka1=4.3×10-7Ka2=5.6×10-11 |
| A. | 等物质的量的Na2CO3和CH3COOH两种溶液混合,一定有:c(Na+)+c(H+)═2c(CO32-)+c(HCO3-)+c(CH3COO-) | |
| B. | 常温下,已知酸H2A存在如下平衡:H2A═H++HA-;HA-═H++A2-(Ka1=5.9×10-2,Ka2=6.4×10-6),则NaHA溶液中水的电离程度一定大于纯水中水的电离程度 | |
| C. | 相同浓度的CH3COONa和NaClO混合溶液中各离子浓度大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 常温下,在0.1mol/LCH3COOH溶液中滴加0.1mol/LNaOH的溶液发生反应,当c(CH3COOH):c(CH3COO-)=5:9时,此时溶液pH=5 |
8.短周期元素X、Y、Z、W 的原子序数依次增大,且原子最外层电子数之和为13.X 的原子半径比Y 的小,X 与W 同主族,Z 是地壳中含量最高的元素.下列说法正确的是( )
| A. | 简单离子半径的大小顺序:r(W)>r(Y)>r(Z) | |
| B. | 元素Z、W 的简单离子的电子层结构不同 | |
| C. | 元素Y 的简单气态氢化物的热稳定性比Z 的强 | |
| D. | W、Y、Z 三种元素的氢化物中,W的熔点最高 |
5.锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:2Na3PO4+4CuSO4+2NH3•H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O.请回答下列问题:
(1)上述方程式中涉及到的N、O元素电负性由小到大的顺序是N<O.
(2)基态S的价电子排布式为3s23p4.与Cu同周期且最外层电子数相等的元素还有K、Cr(填元素符号).
(3)PO43-的空间构型是正四面体,其中P原子的杂化方式为sp3.
(4)在硫酸铜溶液中加入过量KCN溶液,生成配合物[Cu(CN)4]2-,则1molCN-中含有的π键数目为2NA.
(5)铜晶体为面心立方最密集堆积,铜的原子半径为127.8pm,列式计算晶体铜的密度9.0g/cm3.
(6)表中列出了含氧酸酸性强弱与非羟基氧原子数的关系.
由此可得出的判断含氧酸强弱的一条经验规律是含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强.亚磷酸(H3PO3)也是中强酸,它的结构式为 .亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O.
.亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O.
(1)上述方程式中涉及到的N、O元素电负性由小到大的顺序是N<O.
(2)基态S的价电子排布式为3s23p4.与Cu同周期且最外层电子数相等的元素还有K、Cr(填元素符号).
(3)PO43-的空间构型是正四面体,其中P原子的杂化方式为sp3.
(4)在硫酸铜溶液中加入过量KCN溶液,生成配合物[Cu(CN)4]2-,则1molCN-中含有的π键数目为2NA.
(5)铜晶体为面心立方最密集堆积,铜的原子半径为127.8pm,列式计算晶体铜的密度9.0g/cm3.
(6)表中列出了含氧酸酸性强弱与非羟基氧原子数的关系.
| 次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
| 含氧酸 | Cl-OH | 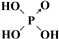 | 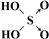 | 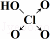 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
 .亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O.
.亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O.
12.一块11.0g的铁铝合金,加入一定量的稀硫酸后合金完全溶解,然后加H2O2到溶液中无Fe3+存在,加热除去多余的H2O2,当加入200mL 6mol•L-1NaOH溶液时沉淀量最多,且所得沉淀质量为26.3g,下列说法不正确的是( )
| A. | 该合金中铁的质量为5.6g | |
| B. | 合金与稀硫酸反应共生成0.45mol H2 | |
| C. | 该合金与足量氢氧化钠反应,转移的电子数为0.6NA | |
| D. | 所加的稀硫酸中含0.6molH2SO4 |