题目内容
12.一块11.0g的铁铝合金,加入一定量的稀硫酸后合金完全溶解,然后加H2O2到溶液中无Fe3+存在,加热除去多余的H2O2,当加入200mL 6mol•L-1NaOH溶液时沉淀量最多,且所得沉淀质量为26.3g,下列说法不正确的是( )| A. | 该合金中铁的质量为5.6g | |
| B. | 合金与稀硫酸反应共生成0.45mol H2 | |
| C. | 该合金与足量氢氧化钠反应,转移的电子数为0.6NA | |
| D. | 所加的稀硫酸中含0.6molH2SO4 |
分析 200mL 6mol•L-1 NaOH溶液中含有NaOH的总物质的量为:6mol/L×0.2mol=1.2mol,生成沉淀最多时溶质为硫酸钠,则所加硫酸的物质的量为$\frac{1.2mol}{2}$=0.6mol;
最终得到的沉淀为氢氧化铝和氢氧化铁的混合物,则生成沉淀时消耗氢氧根离子的物质的量为:$\frac{26.3g-11.0g}{17g/mol}$=0.9mol,则铁和铝的总物质的量为:$\frac{0.9mol}{3}$=0.3mol,设合金中铁的物质的量为x、铝的物质的量为y,则56x+27y=11.0、x+y=0.3,解得:x=0.1mol、y=0.2mol,据此对各选项进行判断.
解答 解:最终得到的沉淀为氢氧化铝和氢氧化铁的混合物,则生成沉淀时消耗氢氧根离子的物质的量为:$\frac{26.3g-11.0g}{17g/mol}$=0.9mol,则铁和铝的总物质的量为:$\frac{0.9mol}{3}$=0.3mol,设合金中铁的物质的量为x、铝的物质的量为y,则56x+27y=11.0、x+y=0.3,解得:x=0.1mol、y=0.2mol;
200mL 6mol•L-1 NaOH溶液中含有NaOH的总物质的量为:6mol/L×0.2mol=1.2mol,生成沉淀最多时溶质为硫酸钠,则所加硫酸的物质的量为:$\frac{1.2mol}{2}$=0.6mol,
A.根据计算可知,合金中含有0.1mol铁,其质量为:56g/mol×0.1mol=5.6g,故A正确;
B.0.1mol铁与稀硫酸反应生成0.1mol氢气,0.2mol铝与稀硫酸反应生成0.3mol氢气,总共生成0.4mol氢气,故B错误;
C.铁不与氢氧化钠溶液反应,0.2mol铝与氢氧化钠溶液反应转移电子为:0.2mol×3=0.6mol,转移的电子数为0.6NA,故C正确;
D.根据分析可知,所加硫酸的物质的量为0.6mol,故D正确;
故选B.
点评 本题考查了混合物反应的计算,题目难度中等,明确恰好沉淀时溶质组成为解答关键,注意掌握质量守恒定律、电子守恒在化学计算中的应用,试题侧重考查学生的分析、理解能力及化学计算能力;B为易错点,注意铁与稀硫酸反应生成的是硫酸亚铁.

| A. | 17:5 | B. | 11:3 | C. | 3:1 | D. | 4:1 |
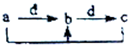 下表各组物质中,物质之间不能通过一步反应实现如图所示转化的( )
下表各组物质中,物质之间不能通过一步反应实现如图所示转化的( )| 物质 选项 | a | b | c | d |
| A | Al | Al(OH)3 | NaAlO2 | NaOH |
| B | C | CO | CO2 | O2 |
| C | NaOH | Na2CO3 | NaHCO3 | CO2 |
| D | AlCl3 | Al(OH)3 | NaAlO2 | NaOH |
| A. | A | B. | B | C. | C | D. | D |
| A. | 溶液中pH醋酸比盐酸大 | |
| B. | 与足量的锌粉反应产生的氢气体积相同 | |
| C. | 与足量锌粒反应时,一开始盐酸的速率快 | |
| D. | 能中和NaOH溶液的物质的量醋酸较少 |

(1)如图1是原子序数相连的七种短周期元素第一电离能示意图.其中硼(B)和氧(O)元素分别是⑤、③(填图中元素代号).
(2)PCl6-和SF6呈正八面体的结构(分别如图2、3),PCl6-阴离子中是(填“是”或“否”)存在配位键,原因是P原子只有5个价电子,但在该离子中P原子形成了6个共价键,必有一个配位键;
如果SF6中的若干个F原子被Cl原子取代形成SFxCl6-x (x不为0),则SFxCl6-x不同分子种数为C.
A.6种 B.7种 C.9种 D.12种
(3)Mn、Fe均为第四周期过渡元素,两元素的部分电离能(I)数据列于如表:
| 元素 | Mn | Fe | |
| 电离能(KJ•mol-1) | Ⅰ1 | 717 | 759 |
| Ⅰ2 | 1509 | 1561 | |
| Ⅰ3 | 3248 | 2957 | |
Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物,六氰合铁(Ⅲ)离子[Fe(CN)6]3- 中的配体CN- 中C原子的杂化轨道类型是sp,写出一种与CN- 互为等电子体的单质分子的结构式N≡N.
(1)将PM2.5样本用蒸馏水处理制成待测试样.
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.已知:H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ•mol-1
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ•mol-1
写出焦炭与水蒸气反应的热化学方程式:C(s)+H2O(g)=CO(g)+H2(g)△H=+13l.3kJ•mol-1.
②洗涤含SO2的烟气.以下物质可作洗涤剂的是a、b.
a.Ca(OH)2 b.Na2CO3 c.CaCl2d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化
①已知汽缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0若1mol空气含0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol.计算该温度下的平衡常数K=4×10-6.汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是温度升高,反应速率加快,平衡右移.
②目前,在汽车尾气系统中安装催化转化器可减少CO和NO的污染,反应方程式为2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.
| A. | 不能让小学生咬铅笔头,否则会引起铅中毒 | |
| B. | 食用碱用于面包加工,可以使面包疏松 | |
| C. | 铝合金用作门窗框架,这是利用了合金硬度大的特征 | |
| D. | 烧碱和冰醋酸均为电解质 |
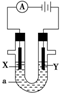 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: