题目内容
10.今有①CH3COOH ②HCl ③H2SO4 三种溶液.根据要求回答下列问题:(1)当它们pH相同时,其物质的量浓度最大的是①(填序号).
(2)当它们的物质的量浓度相同时,其pH最小的是③(填序号).
(3)将c(H+)相同的三种酸均加水稀释至原来的10倍,c(H+)由大到小的顺序为①>②=③.(填序号)
(4)体积和物质的量浓度均相同的①②③三种酸溶液,分别与相同浓度的烧碱溶液恰好完全反应,所需烧碱的体积比为1:1:2;此时所得到的三种溶液的pH大小关系为①>②=③(填序号).
分析 (1)pH相同溶液中氢离子浓度相同,依据醋酸是弱酸,硫酸是二元酸分析判断;
(2)pH=-lgc(H+),浓度相同,溶液pH大小由溶液中氢离子浓度大小分析计算判断;
(3)醋酸是弱电解质加水稀释促进电离,所以稀释后醋酸氢离子浓度最大,而盐酸和硫酸氢离子的浓度只减小;
(4)溶液中溶质物质的量相同时,硫酸是二元强酸;醋酸是弱酸,弱酸强碱盐水解显碱性.
解答 解:(1)当它们pH相同时,溶液中氢离子浓度相同,假设提供1mol/L的氢离子,需要醋酸浓度应大于1mol/L;需要②HCl溶液浓度为1mol/L;需要③H2SO4 溶液浓度为0.5mol/L,则物质的量浓度最大的为①,
故答案为:①;
(2)当它们的物质的量浓度相同时,假设浓度都是1mol/L:①CH3COOH溶液电离出氢离子浓度小于1mol/L,②HCl电离出氢离子浓度为1mol/L,③H2SO4电离出的氢离子浓度为2mol/L,氢离子浓度越大,溶液的pH越小,则溶液的pH最小的为③,
故答案为:③;
(3)醋酸是弱电解质加水稀释促进电离,所以稀释后醋酸氢离子浓度最大,而盐酸和硫酸氢离子的浓度只减小且相等,所以c(H+)由大到小的顺序为:①>②=③,
故答案为:①>②=③;
(4)体积和物质的量浓度均相同的①②③三种酸溶液,醋酸和盐酸是一元酸,硫酸是二元酸,分别与相同浓度的烧碱溶液恰好完全反应,所需烧碱的体积比为1:1:2;盐酸和硫酸是强酸,醋酸是弱酸,弱酸强碱盐水解显碱性,强酸强碱盐不水解,溶液显中性,三种溶液的pH大小关系为①>②=③,
故答案为:1:1:2;①>②=③.
点评 本题考查了弱电解质的电离及其影响,题目难度中等,明确电离平衡的影响因素为解答关键,注意掌溶液酸碱性与溶液pH的关系,试题培养了学生的灵活应用能力.

| A. | 溶液中pH醋酸比盐酸大 | |
| B. | 与足量的锌粉反应产生的氢气体积相同 | |
| C. | 与足量锌粒反应时,一开始盐酸的速率快 | |
| D. | 能中和NaOH溶液的物质的量醋酸较少 |
| A. | 把pH=2的甲酸溶液稀释100倍后pH=3.5 | |
| B. | 0.1 mol•L-1的甲酸溶液的pH约为2 | |
| C. | HCOONa溶液能使酚酞试液变红 | |
| D. | 50mL l mol•L-1的甲酸溶液恰好与50mL l mol•L-1的NaOH溶液完全反应 |
| A. | 不能让小学生咬铅笔头,否则会引起铅中毒 | |
| B. | 食用碱用于面包加工,可以使面包疏松 | |
| C. | 铝合金用作门窗框架,这是利用了合金硬度大的特征 | |
| D. | 烧碱和冰醋酸均为电解质 |
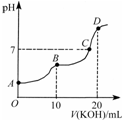
| A. | KHC2O4溶液呈弱碱性 | |
| B. | B点时:c(HC2O4-)>c(K+)>c(H+)>c(OH-) | |
| C. | C点时:c(HC2O4-)+c(C2O42-)+c(H2C2O4)<c(K+)<c(HC2O4-)+2c(C2O42-)+c(H2C2O4) | |
| D. | D点时:c(H+)+c(HC2O4-)+c(H2C2O4)=c(OH-) |
| A. | 醋酸:一元强酸 | B. | CaCO3:弱电解质 | C. | CO2:电解质 | D. | NaHSO4:酸式盐 |
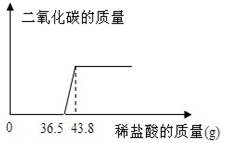 欲测定某氢氧化钠样品中可能的变质成分碳酸钠的含量,张同学取该样品少量放于烧杯中,向其中慢慢滴加10%的稀盐酸,所加盐酸与产生气体的质量关系图如下:
欲测定某氢氧化钠样品中可能的变质成分碳酸钠的含量,张同学取该样品少量放于烧杯中,向其中慢慢滴加10%的稀盐酸,所加盐酸与产生气体的质量关系图如下: