题目内容
12.下列叙述中正确的是( )| A. | 在碱金属元素中,所有碱金属的氧化物均属于碱性氧化物 | |
| B. | 由于活泼性Na<K,故金属钾可以从NaCl 溶液中置换出钠单质 | |
| C. | 金属锂不能保存在煤油中,金属钾可以保存在煤油中 | |
| D. | 碱金属在自然界中都以游离态存在 |
分析 A.过氧化物等不是碱性氧化物,碱金属的普通氧化物为碱性氧化物;
B.K与水先反应;
C.Li的密度小,保存在石蜡中,K可保存在煤油中隔绝空气;
D.碱金属的性质活泼,主要以化合态存在.
解答 解:A.只有碱金属的普通氧化物为碱性氧化物,过氧化物、超氧化物不是,故A错误;
B.K与水先反应,不能与NaCl溶液发生置换反应生成Na,故B错误;
C.Li的密度小,保存在石蜡中,K可保存在煤油中隔绝空气,保存方法合理,故C正确;
D.碱金属的性质活泼,主要以化合态存在,故D错误;
故选C.
点评 本题考查碱金属的性质,为高频考点,把握物质的性质、发生的反应、试剂保存、物质的存在形态等为解答的关键,侧重分析与应用能力的考查,注意选项B为易错点,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.若R是元素周期表中第六周期、第ⅦA族元素,下列有关R的叙述,正确的是( )
| A. | R的单质在通常情况下呈气态 | B. | R的单质可能是一种无色的固体 | ||
| C. | R的氢化物稳定 | D. | 单质R与H2的化合反应非常困难 |
20.某消毒液的主要成分为NaClO,还含有一定量的NaOH,下列用来解释事实的方程式中不合理的是(已知:饱和NaClO溶液的pH约为11)( )
| A. | 该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | 该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ClO-=HClO+CH3COO- | |
| C. | 该消毒液与洁厕灵(成分为HCl)混用,产生Cl2:2H++Cl-+ClO-=Cl2↑+H2O | |
| D. | 该消毒液的pH约为12:ClO-+H2O?HClO+OH- |
17.化学与生产生活、环境密切相关,下列说法正确的是( )
| A. | 农作物收获后,就地焚烧秸秆,增加土壤中钾肥含量 | |
| B. | 用于新版人民币票面图案等处的油墨中所含的Fe3O4是一种磁性物质 | |
| C. | 双氧水、高锰酸钾溶液可以杀死埃博拉病毒,其消毒原理与漂白粉消毒饮用水的原理不相同 | |
| D. | 淘米水中含有淀粉可以直接检测加碘盐中是否含有碘元素 |
4.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | NA个氧气分子与NA个氖气分子的质量比是4:5 | |
| B. | 17gOH-与19gH3O+所含电子数相等 | |
| C. | 32gSO2和40gSO3所含的原子数相等 | |
| D. | 标准状况下,11.2LCO2与常温常压下17gNH3所含分子数相等 |
2.下列叙述正确的是( )
| A. | 1 mol H2SO4的质量为98g•mol-1 | |
| B. | H2SO4的摩尔质量为98g | |
| C. | 9.8 g H2SO4含有NA个H2SO4分子 | |
| D. | 6.02×1022个H2SO4分子的质量为9.8g |
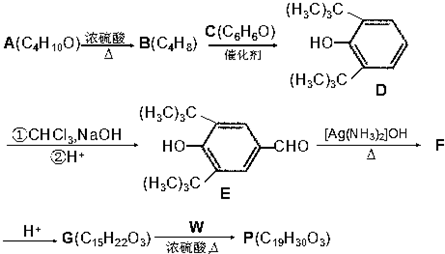
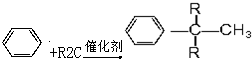 (R为烷基)
(R为烷基)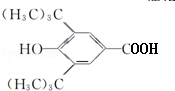 ;E中含有的官能团名称是羟基和醛基;
;E中含有的官能团名称是羟基和醛基;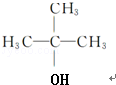 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O;该反应类型为消去反应;
+H2O;该反应类型为消去反应;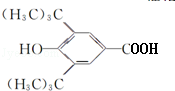 +CH3CH2CH2CH2OH$→_{△}^{浓H_{2}SO_{4}}$
+CH3CH2CH2CH2OH$→_{△}^{浓H_{2}SO_{4}}$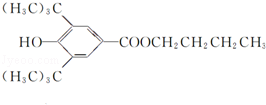 +H2O;该反应类型为酯化反应;
+H2O;该反应类型为酯化反应;
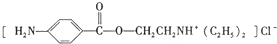 )是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下:
)是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下: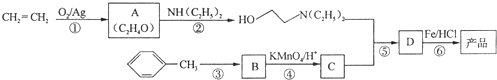
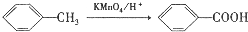
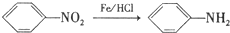

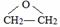 .
.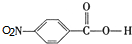 ,C中含有的含氧官能团的名称为硝基、羧基.
,C中含有的含氧官能团的名称为硝基、羧基.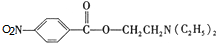 +H2O.
+H2O.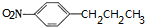 (任写一种).
(任写一种).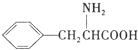 )是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式
)是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式 .
.