题目内容
13.下列化合物中同类别同分异构体数目最多的是(不考虑立体异构)( )| A. | 二甲苯 | B. | 丁醇 | C. | 一氯丁烯 | D. | 二氯丙烷 |
分析 A、二甲苯的同分异构体中,可以是两个甲基连在苯环上,还可以是乙基连在苯环上;
B、丁基有四种,据此确定丁醇数目;
C、丁烯有3种同分异构体,分别是1-丁烯、2-丁烯、2-甲基-1-丙烯,然后依次分析三种烯烃满足题目要求结构的一氯丁烯;
D、二氯丙烷存在氯原子的位置异构.
解答 解:A、二甲苯的同分异构体中,可以是两个甲基连在苯环上,还可以是乙基连在苯环上,共4种;
B、丁基有四种,据此确定丁醇是四种;
C、丁烯有3种同分异构体,分别是1-丁烯、2-丁烯、2-甲基-1-丙烯,一氯丁烯存在官能团的位置异构,共8种;
D、二氯丙烷存在氯原子的位置异构,共四种.
化合物中同类别同分异构体数目最多的是C.故选C.
点评 本题考查了同分异构体数目的求算,题目难度中等,明确同分异构体的书写原则为解答关键,试题侧重考查学生灵活应用基础知识的能力.

练习册系列答案
相关题目
4.自来水中游离氯的测定.设计如下实验:取一定量自来水置于锥形瓶中,加入足量的KI溶液及2~3滴指示剂,用0.0010mol•L-1的Na2S2O3溶液滴定反应中生成的I2(I2被还原为I-,S2O32-被氧化为S4O62-),根据消耗的Na2S2O3溶液的体积计算出自来水中游离氯的浓度.请回答下列问题:
(1)写出Na2S2O3与I2反应的离子方程式I2+2S2O32-=2I-+S4O62-.
(2)滴定中使用的指示剂是淀粉溶液,滴定终点的现象是蓝色溶液恰好变为无色且半分钟内不恢复.
(3)该小组同学的实验数据如下表:
请根据上表数据计算该自来水中游离氯(Cl2)的物质的量浓度.0.0010mol•L-1(写出计算过程,否则不得分)
(4)若实验中的锥形瓶用自来水洗净后未用蒸馏水洗涤,则实验值大于(填“大于、小于或等于”)实际值.
(1)写出Na2S2O3与I2反应的离子方程式I2+2S2O32-=2I-+S4O62-.
(2)滴定中使用的指示剂是淀粉溶液,滴定终点的现象是蓝色溶液恰好变为无色且半分钟内不恢复.
(3)该小组同学的实验数据如下表:
| 实验序号 | 自来水的体积 | KI溶液的体积 | 消耗的Na2S2O3溶液的体积 |
| 1 | 10.00mL | 10.00mL | 19.96mL |
| 2 | 10.00mL | 10.00mL | 20.04mL |
(4)若实验中的锥形瓶用自来水洗净后未用蒸馏水洗涤,则实验值大于(填“大于、小于或等于”)实际值.
1.向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量.其中主要含硫各物种(H2S、HS-、S2-)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出).下列说法不正确的是( )
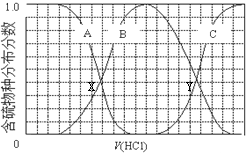

| A. | 含硫物种B表示HS- | |
| B. | 在滴加盐酸过程中,溶液中c(Na+)与含硫各物种浓度的大小关系为:c(Na+)=3[c(H2S)+c(HS-)+c(S2-)] | |
| C. | X,Y为曲线的两交叉点,若能知道X点处的pH,就可以计算出H2S的Ka值 | |
| D. | NaHS呈碱性,若向溶液中加入CuSO4溶液,恰好完全反应,所得溶液呈强酸性,其原因是Cu2++HS-═CuS↓+H+ |
8.已知aAn+、bB(n+1)+、cCn-、dD(n+1)-均具有相同的电子层结构,关于A、B、C、D四种元素的叙述正确的是( )
| A. | 原子半径A>B>D>C | B. | 原子序数a>b>c>d | ||
| C. | 离子半径D>C>B>A | D. | 金属性B>A,非金属性D>C |
18.氮、磷、砷是原子序数依次增大的第VA族元素,它们的化合物有着独特的性质和重要用途.
(1)基态砷原子的核外电子排布式为[Ar]3d104s24p3.氮、磷、砷的第一电离能顺序为N>P>As(填元素符号).
(2)已知N2O为直线形结构,结构式为N=N=O.则N2O是极性(填“极性”或“非极性”)分子.中间的氮原子的杂化轨道类型为sp杂化.
(3)已知下列数据:
NH3的熔、沸点均高于PH3的原因是氨分子之间能形成氢键;PH3的分解温度高于其沸点,其原因是PH3分解需要破坏P-H键,PH3气化需要破坏分子间作用力,而化学键比分子间作用力强得多.
(4)根据价层电子对互斥理论,氨分子中的键角<(填“>”、“<”或“=”)109°28′;PO43-离子的空间构型为正四面体.
(5)磷化铝的结构与金刚石相似,其结构单元如图所示:
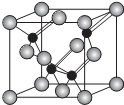
①经过计算,该晶体的化学式是AlP.
②该晶体中是(填“是”或“否”)存在配位键.
(1)基态砷原子的核外电子排布式为[Ar]3d104s24p3.氮、磷、砷的第一电离能顺序为N>P>As(填元素符号).
(2)已知N2O为直线形结构,结构式为N=N=O.则N2O是极性(填“极性”或“非极性”)分子.中间的氮原子的杂化轨道类型为sp杂化.
(3)已知下列数据:
| 物质 | 熔点/K | 沸点/K | 分解温度/K |
| NH3 | 195.3 | 239.7 | 1073 |
| PH3 | 139.2 | 185.4 | 713.2 |
(4)根据价层电子对互斥理论,氨分子中的键角<(填“>”、“<”或“=”)109°28′;PO43-离子的空间构型为正四面体.
(5)磷化铝的结构与金刚石相似,其结构单元如图所示:

①经过计算,该晶体的化学式是AlP.
②该晶体中是(填“是”或“否”)存在配位键.
5.甲烷的用途很广泛.
(1)已知:
2NO2(g )═N2O4(g)△H=-56.9kJ•mol -1
H2O(g)=H2O(l)△H=-44.0kJ•mol -1
CH4(g)+N2O4 (g)=N2(g)+2H2O(l)+CO2 (g)△H=-898.1kJ•mol -1
则 CH4(g)催化还原NO2 (g)生成 N2(g)和H2O(g)的热化学方程式为CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g),△H=-867kJ•mol-1.
(2)一定条件下,发生2NO(g)+2CO(g)$\stackrel{催化剂}{?}$N2(g)+2CO2(g)△H<0.在不同时间c(NO)与c(CO)如下表所示:
①该温度下,该反应的平衡常数表达式为K=$\frac{c({N}_{2}){c}^{2}(C{O}_{2})}{{c}^{2}(NO){c}^{2}(CO)}$;
②计算前4秒内氮气的平均反应速率为9.375×10-5mol/(L•s);
③下列选项中,不能说明上述反应已达平衡的是AC
A.2v正(NO)=v逆(N2 )
B.容器中气体的平均分子量不随时间而变化
C.容器中气体的密度不随时间而变化
D.容器中CO的质量不再发生变化
E. 容器中气体的总压强不随时间而变化
(3)CH4燃料电池原理如图所示
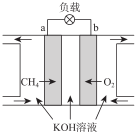
①该燃料电池的正极为b(填“a”或“b”).该电池负极的电极反应式为CH4+10OH--8e-=CO32-+7H2O;
②放电一段时间后,电解质溶液的pH减小(填“增大”、“减小”或“不变”).
(1)已知:
2NO2(g )═N2O4(g)△H=-56.9kJ•mol -1
H2O(g)=H2O(l)△H=-44.0kJ•mol -1
CH4(g)+N2O4 (g)=N2(g)+2H2O(l)+CO2 (g)△H=-898.1kJ•mol -1
则 CH4(g)催化还原NO2 (g)生成 N2(g)和H2O(g)的热化学方程式为CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g),△H=-867kJ•mol-1.
(2)一定条件下,发生2NO(g)+2CO(g)$\stackrel{催化剂}{?}$N2(g)+2CO2(g)△H<0.在不同时间c(NO)与c(CO)如下表所示:
| 时间/s | 0 | 2 | 4 | 6 | 8 | 10 |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol•L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
②计算前4秒内氮气的平均反应速率为9.375×10-5mol/(L•s);
③下列选项中,不能说明上述反应已达平衡的是AC
A.2v正(NO)=v逆(N2 )
B.容器中气体的平均分子量不随时间而变化
C.容器中气体的密度不随时间而变化
D.容器中CO的质量不再发生变化
E. 容器中气体的总压强不随时间而变化
(3)CH4燃料电池原理如图所示

①该燃料电池的正极为b(填“a”或“b”).该电池负极的电极反应式为CH4+10OH--8e-=CO32-+7H2O;
②放电一段时间后,电解质溶液的pH减小(填“增大”、“减小”或“不变”).
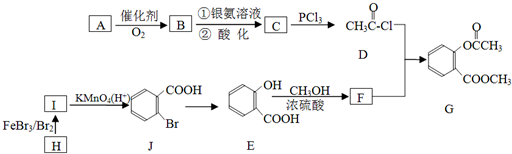
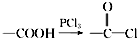 ,请回答以下问题:
,请回答以下问题: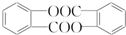 .
.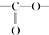 结构
结构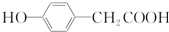 .
.