题目内容
16.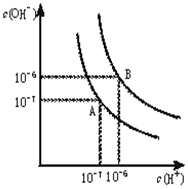 水的电离平衡曲线如下图所示.
水的电离平衡曲线如下图所示.(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从10-14增加到10-12.
(2)将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为2:9.
(3)已知AnBm的离子积=[c(Am+)]n•[c(Bn-)]m,式中c(Am+)n和c(Bn-)m表示离子的物质的量浓度.在某温度下,Ca(OH)2的溶解度为0.74g,其饱和溶液密度设为1g/mL,其离子积为4×10-3.
分析 (1)Kw=c(H+).c(OH-),A点c(H+)=c(OH-)=10-7mol/L,B点c(H+)=c(OH-)=10-6mol/L;
(2)将pH=8的Ba(OH)2溶液中c(OH-)=10-4mol/L,pH=5的稀盐酸中c(H+)=10-5 mol/L,设氢氧化钡的体积为x,盐酸的体积为y,
100℃的恒温,欲使混合溶液pH=7,溶液呈碱性,混合溶液中c(OH-)=$\frac{1{0}^{-12}}{1{0}^{-7}}$mol/L=10-5 mol/L,c(OH-)=$\frac{1{0}^{-4}x-1{0}^{-5}y}{x+y}$=10-5 mol/L;
(3)若某温度下Ca(OH)2的溶解度为0.74g,设饱和溶液的密度为1g/mL,则100g水中溶解0.74gCa(OH)2时Ca(OH)2的C=$\frac{\frac{0.74g}{74g/mol}}{\frac{100g+0.74g}{1g/mL}×1{0}^{-3}L/mL}$≈0.1mol/L,Ca(OH)2是强电解质,所以c[Ca(OH)2]=c(Ca2+ )=0.1mol/L,c(OH-)=2c[Ca(OH)2]=0.2mol/L,离子积=[c(Am+)]n[c(Bn-)]m=c(Ca2+ ).c(OH-)2.
解答 解:(1)A点纯水中c(H+)=c(OH-)=10-7 mol/L,Kw=c(H+).c(OH-)=10-14 ,当温度升高到100℃,纯水中c(H+)=c(OH-)=10-6 mol/L,Kw=c(H+).c(OH-)=10-12 ;
故答案为:10-14 ;10-12;
(2)将pH=8的Ba(OH)2溶液中c(OH-)=10-4mol/L,pH=5的稀盐酸中c(H+)=10-5 mol/L,设氢氧化钡的体积为x,盐酸的体积为y,
100℃的恒温,欲使混合溶液pH=7,溶液呈碱性,混合溶液中c(OH-)=$\frac{1{0}^{-12}}{1{0}^{-7}}$mol/L=10-5 mol/L,c(OH-)=$\frac{1{0}^{-4}x-1{0}^{-5}y}{x+y}$=10-5 mol/L,x:y=2:9,故答案为:2:9;
(3)若某温度下Ca(OH)2的溶解度为0.74g,设饱和溶液的密度为1g/mL,则100g水中溶解0.74gCa(OH)2时Ca(OH)2的C=$\frac{\frac{0.74g}{74g/mol}}{\frac{100g+0.74g}{1g/mL}×1{0}^{-3}L/mL}$≈0.1mol/L,Ca(OH)2是强电解质,所以c[Ca(OH)2]=c(Ca2+ )=0.1mol/L,c(OH-)=2c[Ca(OH)2]=0.2mol/L,离子积=[c(Am+)]n[c(Bn-)]m=c(Ca2+ ).c(OH-)2=0.1mol/L×(0.2mol/L)2=4×10-3(mol/L)3,
故答案为:4×10-3.
点评 本题考查酸碱混合溶液定性判断及离子积常数的有关计算,侧重考查学生分析判断、计算及理解运用能力,明确酸碱混合溶液pH计算方法、物质的量浓度的计算方法是解本题关键,难点是(3)题的理解和运用.

| A. | CaO | B. | Ca(OH)2 | C. | SiO2 | D. | Al2O3 |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
①试管;②泥三角;③蒸发皿;④试管夹;⑤坩埚;⑥玻璃棒;⑦石棉网;⑧坩埚钳.
| A. | ①②④ | B. | ②⑤⑧ | C. | ③⑧⑥ | D. | ⑥⑦ |
| 实验序号 | I | II | III | IV |
| NaOH溶液的体积(mL) | 50.0 | 50.0 | 50.0 | 50.0 |
| 样品质量(g) | 3.44 | m | 17.2 | 21.5 |
| NH3体积(L) | 1.12 | 2.24 | 5.60 | 5.60 |
(1)m=6.88g;c(NaOH)=5.00mol•L-1.
(2)样品中NH4NO3和(NH4)2SO4物质的量之比为1:2.
| A. | 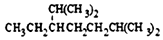 2,6-二甲基-5-乙基庚烷 | B. | 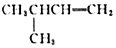 3-甲基-1-丁烯 | ||
| C. | 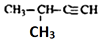 2-甲基-3-丁烯 | D. | 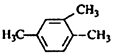 1,3,4-三甲苯 |
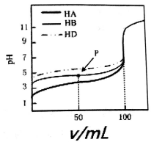
| A. | HA、HB和HD均为弱酸 | |
| B. | P点时,c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-) | |
| C. | pH=7时,三种溶液中:c(A-)=c(B-)=c(D-) | |
| D. | 三种酸溶液分别被NaOH溶液恰好完全中和后互混:c(HA)+c(HB)+c(HD)═c(OH-)-c(H+) |
| A. | 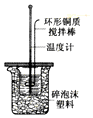 中和反应反应热的测得 | B. | 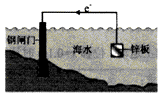 牺牲阳极的阴极保护法 | ||
| C. | 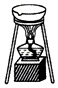 灼烧胆矾晶体测结晶水含量 | D. | 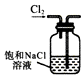 除去Cl2中混有的HCl气体 |
| A. | 0.56 L | B. | 1.344 L | C. | 2.016 L | D. | 2.8 L |