题目内容
现有下列化合物①NaCl、②NaOH、③HCl、④NH4Cl、⑤CH3COONa、⑥CH3COOH、⑦NH3?H2O、⑧H2O,回答问题:
(1)NH4Cl溶液显 性,用离子方程式表示 ,
(2)pH=10的CH3COONa溶液中,水电离出来的c(OH-)为 ,在pH=3的CH3COOH溶液中水电离出来的c(H+)为 .
(3)已知水存在如下平衡:H2O+H2O?H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,从下列四个选项中选择的方法有
A.向水中加入NaHSO4固体
B.向水中加Na2CO3固体
C.加热至100℃
D.向水中加入(NH4)2SO4固体
(4)若等pH、等体积的②和⑦的溶液分别加水稀释m倍、n倍,稀释后pH相等,则m n(填“>”“<”或“=”).
(1)NH4Cl溶液显
(2)pH=10的CH3COONa溶液中,水电离出来的c(OH-)为
(3)已知水存在如下平衡:H2O+H2O?H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,从下列四个选项中选择的方法有
A.向水中加入NaHSO4固体
B.向水中加Na2CO3固体
C.加热至100℃
D.向水中加入(NH4)2SO4固体
(4)若等pH、等体积的②和⑦的溶液分别加水稀释m倍、n倍,稀释后pH相等,则m
考点:盐类水解的原理,水的电离
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:(1)NH4Cl为强酸弱碱盐,水解呈酸性;
(2)CH3COONa为强碱弱酸盐,水解促进水的电离,醋酸抑制水的电离;
(3)欲使平衡向右移动,且所得溶液显酸性,可加入水解呈酸性的盐;
(4)一水合氨为弱电解质,不能完全电离,加水促进电离.
(2)CH3COONa为强碱弱酸盐,水解促进水的电离,醋酸抑制水的电离;
(3)欲使平衡向右移动,且所得溶液显酸性,可加入水解呈酸性的盐;
(4)一水合氨为弱电解质,不能完全电离,加水促进电离.
解答:
解:(1)氯化铵为强酸弱碱盐,铵根离子水解的离子方程式为NH4++H2O?H++NH3?H2O,故答案为:酸;NH4++H2O?H++NH3?H2O;
(2)CH3COONa为强碱弱酸盐,pH=10的CH3COONa溶液中,c(OH-)=10-4mol/L,c(H+)=10-11mol/L,则水电离出来的c(OH-)为10-11mol/L,在pH=3的CH3COOH溶液中,c(OH-)=10-11mol/L,则水电离出来的c(H+)为10-11mol/L,
故答案为:10-4mol/L;10-11mol/L;
(3)A.向水中加入NaHSO4固体,电离出的氢离子抑制水的电离,故A错误;
B.向水中加Na2CO3固体,水解呈碱性,故B错误;
C.加热至100℃,促进水的电离,溶液呈中性,故C错误;
D.向水中加入(NH4)2SO4固体,水解呈酸性,故D正确;
故答案为:D;
(4)氨水为弱电解质,不能完全电离,如稀释相等体积,氨水溶液pH大,如稀释后溶液pH相同,则氨水应加入较多水,
故答案为:<.
(2)CH3COONa为强碱弱酸盐,pH=10的CH3COONa溶液中,c(OH-)=10-4mol/L,c(H+)=10-11mol/L,则水电离出来的c(OH-)为10-11mol/L,在pH=3的CH3COOH溶液中,c(OH-)=10-11mol/L,则水电离出来的c(H+)为10-11mol/L,
故答案为:10-4mol/L;10-11mol/L;
(3)A.向水中加入NaHSO4固体,电离出的氢离子抑制水的电离,故A错误;
B.向水中加Na2CO3固体,水解呈碱性,故B错误;
C.加热至100℃,促进水的电离,溶液呈中性,故C错误;
D.向水中加入(NH4)2SO4固体,水解呈酸性,故D正确;
故答案为:D;
(4)氨水为弱电解质,不能完全电离,如稀释相等体积,氨水溶液pH大,如稀释后溶液pH相同,则氨水应加入较多水,
故答案为:<.
点评:本题考查较为综合,涉及酸碱混合的定性判断和计算、弱电解质的电离、盐类的水解等知识,为高考常见题型,难度中等,注意把握相关基本理论的理解和应用.

练习册系列答案
相关题目
用四氯化碳萃取碘水中的碘,下列说法中不正确的是( )
| A、实验使用的主要仪器是分液漏斗 |
| B、碘在四氯化碳中的溶解度比在水中的溶解度大 |
| C、碘的四氯化碳溶液呈紫红色 |
| D、分液时,水从分液漏斗下口流出,碘的四氯化碳溶液从漏斗上口倒出 |
下列说法错误的是( )
| A、主族元素的原子核外电子最后填入的能级是s能级或p能级 |
| B、BF3、NCl3、H2O分子中所有原子都满足最外层为8电子结构的是NCl3 |
| C、NH4+和CH4属于等电子体,立体构型都是正四面体 |
| D、向盛有硫酸铜溶液的试管里加入过量氨水,将得到蓝色的Cu(OH)2沉淀 |
NA表示阿伏伽德罗常数的数值,下列说法不正确的是( )
| A、将1molNH4NO3溶于一定浓度的稀氨水中,溶液呈中性,若不考虑挥发,溶液中一定含有NA个NH4 |
| B、1mol/LCH3COOH与1mol/L CH3COONa溶液等体积混合,溶液中CH3COOH和CH3COO-的总数为2NA |
| C、常温常压下,3.6g H2O中含有电子数为2NA |
| D、含有2NA个氧原子的氧气与臭氧的混合气体的质量为32g |
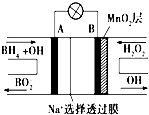 新型NaBH4/H2O2燃料电池(DBFC)的结构如图所示 (已知硼氢化钠中氢为-1价),有关该电池的说法正确的是( )
新型NaBH4/H2O2燃料电池(DBFC)的结构如图所示 (已知硼氢化钠中氢为-1价),有关该电池的说法正确的是( )| A、放电过程中,Na+从正极区向负极区迁移 |
| B、电极B材料中含MnO2层,MnO2可增强导电性 |
| C、电池负极区的电极反应:BH4-+8OH--8e-=BO2-+6H2O |
| D、电池反应中,每消耗1 L 6 mol/L H2O2溶液,理论上流过电路中的电子为6NA个 |
下列不属于四种基本反应类型,但属于氧化还原反应的是( )
| A、Fe+H2SO4═FeSO4+H2↑ | ||||
B、CO+CuO
| ||||
C、Cu2(OH)2CO3
| ||||
| D、4Fe(OH)2+O2+2H2O═4Fe(OH)3 |
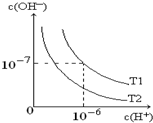 如图是在温度T1、T2时溶液中c(H+)、c(OH-)变化关系图,试回答:
如图是在温度T1、T2时溶液中c(H+)、c(OH-)变化关系图,试回答: