题目内容
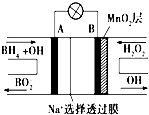 新型NaBH4/H2O2燃料电池(DBFC)的结构如图所示 (已知硼氢化钠中氢为-1价),有关该电池的说法正确的是( )
新型NaBH4/H2O2燃料电池(DBFC)的结构如图所示 (已知硼氢化钠中氢为-1价),有关该电池的说法正确的是( )| A、放电过程中,Na+从正极区向负极区迁移 |
| B、电极B材料中含MnO2层,MnO2可增强导电性 |
| C、电池负极区的电极反应:BH4-+8OH--8e-=BO2-+6H2O |
| D、电池反应中,每消耗1 L 6 mol/L H2O2溶液,理论上流过电路中的电子为6NA个 |
考点:化学电源新型电池
专题:
分析:以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,电解质溶液呈碱性,由工作原理装置图可知,负极发生氧化反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,正极H2O2发生还原反应,得到电子被还原生成OH-,电极反应式为H2O2+2e-=2OH-.
解答:
解:A.放电时,阳离子向正极移动,则钠离子向正极移动,故A错误;
B.电极B采用MnO2,为正极,H2O2发生还原反应,得到电子被还原生成OH-,MnO2既作电极材料又有催化作用,MnO2没有导电性,故B错误;
C.负极发生氧化反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,故C正确;
D.在电池反应中,每消耗1L 6mol/L H2O2溶液,理论上流过电路中的电子数=6mol/L×1L×2×NA/mol=12NA,故D错误;
故选C.
B.电极B采用MnO2,为正极,H2O2发生还原反应,得到电子被还原生成OH-,MnO2既作电极材料又有催化作用,MnO2没有导电性,故B错误;
C.负极发生氧化反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,故C正确;
D.在电池反应中,每消耗1L 6mol/L H2O2溶液,理论上流过电路中的电子数=6mol/L×1L×2×NA/mol=12NA,故D错误;
故选C.
点评:本题考查了原电池原理,涉及电极反应式的书写、电极的判断、离子移动方向等知识点,难点是电极反应式的书写,要结合电解质溶液书写,题目难度中等.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
近年来,食品安全领域相继发生“面粉增白剂”、“彩色馒头”、“毒豆芽”、“牛肉膏”、“硫黄姜”、“地沟油”等事件,温家宝总理痛斥不法分子“道德素质严重滑坡”.下列有关说法错误的是( )
| A、对于能够改善食品的色、香、味,并有防腐、保鲜作用的食品添加剂,不必限量使用 |
| B、“面粉增白剂”中的CaO2具有强氧化性 |
| C、制作“毒豆芽”所用的亚硝酸钠(NaNO2)和使猪肉变“牛肉”时掺入的硼砂(Na2B4O7?10H2O)都属于钠盐 |
| D、“硫黄姜”又黄又亮,可能是在用硫黄熏制的过程中产生的SO2所致 |
电解NaCl溶液的装置如图所示,下列说法不正确的是( )


| A、铁电极上的电极反应式为Fe-2e-=Fe2+ |
| B、溶液中Na+由石墨电极向铁电极移动 |
| C、通电一段时间后,可看到铁电极附近溶液变红 |
| D、通电一段时间后,可看到试管中溶液变蓝 |
将Cu放入0.1mol?L-1的FeCl3溶液中,反应一定时间后取出Cu,溶液中Fe2+、Fe3+的浓度比为3:2,则Cu2+和Fe3+的物质的量之比为( )
| A、3:2 | B、3:5 |
| C、4:3 | D、3:4 |
“分类”是一种思想方法,在化学发展中起到了重要作用.下列说法正确的是( )
| A、氧化还原反应中,一种元素化合价升高,一定有另一种元素化合价降低 |
| B、根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液 |
| C、根据水溶液能否导电将化合物分为电解质和非电解质 |
| D、碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物 |
设NA为阿伏加德罗常数的数值,则下列说法正确的是( )
| A、2.24 L C4H6中含有碳碳叁键数一定为0.1×6.02×1023 |
| B、在标准状态下,11.2 L NO与11.2 L O2混合后气体分子数为0.75NA |
| C、含1molFeCl3的饱和溶液滴入沸水中得到氢氧化铁胶体粒子数目为NA |
| D、120g NaHSO4固体中的离子总数为2NA |
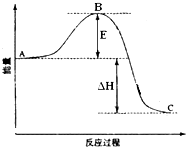 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下列问题:
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下列问题: