题目内容
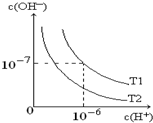 如图是在温度T1、T2时溶液中c(H+)、c(OH-)变化关系图,试回答:
如图是在温度T1、T2时溶液中c(H+)、c(OH-)变化关系图,试回答:(1)试判断温度大小关系:T1
(2)温度T1时,0.005mol/L的H2SO4溶液中:
①c(H+)=
②c(OH-)=
③由水电离出的c(H+)水浓度=
(3)温度T1时,将0.005mol?L-1的H2SO4溶液和0.03mol?L-1的 NaOH溶液按体积比为1:1混合,混合后溶液的PH为
考点:酸碱混合时的定性判断及有关ph的计算,离子积常数
专题:
分析:(1)水的电离是吸热反应,升高温度促进水电离,水的离子积常数增大;
(2)温度T1时,水的离子积常数K=c(H+).c(OH-)=10-6.10-6=10-12,
①硫酸是强电解质,在水溶液里完全电离,水也电离,但电离程度较小,所以该溶液中主要以硫酸电离出的氢离子为主,则该溶液中c(H+)=2c(H2SO4);
②c(OH-)=
;
③酸或碱抑制水电离,该溶液中由水电离出的c(H+)水浓度=c(OH-);
(3)温度T1时,将0.005mol?L-1的H2SO4溶液和0.03mol?L-1的 NaOH溶液按体积比为1:1混合,设酸、碱体积都是xL,混合后溶液中c(OH-)=
=0.01mol/L,溶液中c(H+)=
mol/L=10-10mol/L,据此计算溶液的pH.
(2)温度T1时,水的离子积常数K=c(H+).c(OH-)=10-6.10-6=10-12,
①硫酸是强电解质,在水溶液里完全电离,水也电离,但电离程度较小,所以该溶液中主要以硫酸电离出的氢离子为主,则该溶液中c(H+)=2c(H2SO4);
②c(OH-)=
| Kw |
| c(H+) |
③酸或碱抑制水电离,该溶液中由水电离出的c(H+)水浓度=c(OH-);
(3)温度T1时,将0.005mol?L-1的H2SO4溶液和0.03mol?L-1的 NaOH溶液按体积比为1:1混合,设酸、碱体积都是xL,混合后溶液中c(OH-)=
| 0.03xmol-(0.005×2×x)mol |
| 2xL |
| 10-12 |
| 0.01 |
解答:
解:(1)水的电离是吸热反应,升高温度促进水电离,水的离子积常数增大,根据图象知T1的离子积常数大于T2,所以T1 大于T2,故答案为:>;
(2)温度T1时,水的离子积常数K=c(H+).c(OH-)=10-6.10-6=10-12,
①硫酸是强电解质,在水溶液里完全电离,水也电离,但电离程度较小,所以该溶液中主要以硫酸电离出的氢离子为主,则该溶液中c(H+)=2c(H2SO4)=0.005mol/L×2=0.01mol/L,
故答案为:0.01;
②c(OH-)=
=
mol/L=10-10mol/L,
故答案为:10-10;
③酸或碱抑制水电离,该溶液中由水电离出的c(H+)水浓度=c(OH-)=10-10mol/L,
故答案为:10-10;
(3)温度T1时,将0.005mol?L-1的H2SO4溶液和0.03mol?L-1的 NaOH溶液按体积比为1:1混合,设酸、碱体积都是xL,混合后溶液中c(OH-)=
=0.01mol/L,溶液中c(H+)=
mol/L=10-10mol/L,则溶液的pH=10,
故答案为:10.
(2)温度T1时,水的离子积常数K=c(H+).c(OH-)=10-6.10-6=10-12,
①硫酸是强电解质,在水溶液里完全电离,水也电离,但电离程度较小,所以该溶液中主要以硫酸电离出的氢离子为主,则该溶液中c(H+)=2c(H2SO4)=0.005mol/L×2=0.01mol/L,
故答案为:0.01;
②c(OH-)=
| Kw |
| c(H+) |
| 10-12 |
| 0.01 |
故答案为:10-10;
③酸或碱抑制水电离,该溶液中由水电离出的c(H+)水浓度=c(OH-)=10-10mol/L,
故答案为:10-10;
(3)温度T1时,将0.005mol?L-1的H2SO4溶液和0.03mol?L-1的 NaOH溶液按体积比为1:1混合,设酸、碱体积都是xL,混合后溶液中c(OH-)=
| 0.03xmol-(0.005×2×x)mol |
| 2xL |
| 10-12 |
| 0.01 |
故答案为:10.
点评:本题考查酸碱混合溶液定性判断及pH的简单计算,明确离子积常数与温度的关系是解本题关键,注意离子积常数只与温度有关,与溶液酸碱性无关,难点是(2)③中水电离出氢离子浓度的计算,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列物质间的转化在给定条件下能够实现的是( )
①Al2O3
NaAlO2(aq)或Na[Al(OH)4](aq)
Al(OH)3
②S
SO3
H2SO4
③NaOH(aq)
NaHCO3
Na2CO3
④Fe2O3
FeCl3(aq)
无水FeCl3
⑤NH4Cl(s)
NH3
NH4HCO3.
①Al2O3
| NaOH(aq) |
| △ |
| CO2 |
②S
| O2 |
| 点燃 |
| H2O |
③NaOH(aq)
| 足量CO2 |
| △ |
④Fe2O3
| HCl(aq) |
| △ |
⑤NH4Cl(s)
| 熟石灰 |
| △ |
| H2O、CO2 |
| A、①③⑤ | B、②③④ |
| C、②④⑤ | D、①④⑤ |
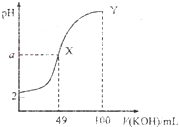 常温下向100mL0.1mol?L-1HA溶液中逐滴加入0.2mol?L-1KOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计),已知X点溶液呈中性.下列说法中,不正确的是( )
常温下向100mL0.1mol?L-1HA溶液中逐滴加入0.2mol?L-1KOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计),已知X点溶液呈中性.下列说法中,不正确的是( )| A、HA为一元弱酸 |
| B、X点溶液的温度高于Y点 |
| C、X点水的电离程度大于Y点水的电离程度 |
| D、Y点对应点的溶液中c(K+)>c(A-)>c(OH-) |
化学与生产、生活、社会密切相关.下列有关说法中,错误的是( )
| A、服用铬含量超标的药用胶囊会对人体健康造成危害 |
| B、镀层破坏后,镀锡铁板比镀锌铁板更耐腐蚀 |
| C、关闭高能耗的化工企业,体现了“低碳经济”的宗旨 |
| D、雾霾主要是由化石燃料燃烧排放的二氧化硫、氮氧化物、烟尘以及机动车尾气、建筑扬尘等导致的 |
反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g)在 5L密闭容器中进行,30秒后,NO的物质的量增加了0.3mol,则此反应的平均速率v(x)(表示反应物的消耗速率或生成物的生成速率)为( )
| A、v (O2)=0.0l mol?L-1?s-1 |
| B、v (NO)=0.001 mol?L-1?s-1 |
| C、v (NH3)=0.001 mol?L-1?s-1 |
| D、v (H2O)=0.003 mol?L-1?s-1 |
电解NaCl溶液的装置如图所示,下列说法不正确的是( )
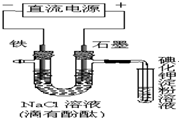

| A、铁电极上的电极反应式为Fe-2e-=Fe2+ |
| B、溶液中Na+由石墨电极向铁电极移动 |
| C、通电一段时间后,可看到铁电极附近溶液变红 |
| D、通电一段时间后,可看到试管中溶液变蓝 |
下列物质中属于非电解质的是( )
| A、H2 |
| B、氨水 |
| C、CO2 |
| D、H2SO4 |