题目内容
下列说法错误的是( )
| A、主族元素的原子核外电子最后填入的能级是s能级或p能级 |
| B、BF3、NCl3、H2O分子中所有原子都满足最外层为8电子结构的是NCl3 |
| C、NH4+和CH4属于等电子体,立体构型都是正四面体 |
| D、向盛有硫酸铜溶液的试管里加入过量氨水,将得到蓝色的Cu(OH)2沉淀 |
考点:原子核外电子排布,判断简单分子或离子的构型,配合物的成键情况
专题:
分析:A、主族元素原子的外围电子排布为nsx、ns2npy(零族元素除外);
B、化合物中元素的最外层电子数+化合价的绝对值=8,则该元素满足8电子稳定结构,否则不是;
C、根据等电子体结构相似;
D、向盛有硫酸铜溶液的试管里加入过量氨水,得到蓝色溶液,该反应的离子方程式为:Cu2++4NH3?H2O═[Cu(NH3)4]2++4H2O.
B、化合物中元素的最外层电子数+化合价的绝对值=8,则该元素满足8电子稳定结构,否则不是;
C、根据等电子体结构相似;
D、向盛有硫酸铜溶液的试管里加入过量氨水,得到蓝色溶液,该反应的离子方程式为:Cu2++4NH3?H2O═[Cu(NH3)4]2++4H2O.
解答:
解:A、主族元素原子的外围电子排布为nsx、ns2npy(零族元素除外),故主族元素的原子核外电子最后填入的能级是s能级或p能级,故A正确;
B、H2O中H只满足2个电子的稳定结构,BF3中B所含电子数为3+3=6个,NCl3中N、Cl所含电子数为5+3=8、7+1=8,故B正确;
C、NH4+和CH4的原子数、价电子数都相等,中心原子的价层电子对数均为4,因此空间构型都是正四面体,故C正确;
D、向盛有硫酸铜溶液的试管里加入过量氨水,得到蓝色溶液,该反应的离子方程式为:Cu2++4NH3?H2O═[Cu(NH3)4]2++4H2O,因此无Cu(OH)2蓝色沉淀,故D错误;
故选D.
B、H2O中H只满足2个电子的稳定结构,BF3中B所含电子数为3+3=6个,NCl3中N、Cl所含电子数为5+3=8、7+1=8,故B正确;
C、NH4+和CH4的原子数、价电子数都相等,中心原子的价层电子对数均为4,因此空间构型都是正四面体,故C正确;
D、向盛有硫酸铜溶液的试管里加入过量氨水,得到蓝色溶液,该反应的离子方程式为:Cu2++4NH3?H2O═[Cu(NH3)4]2++4H2O,因此无Cu(OH)2蓝色沉淀,故D错误;
故选D.
点评:本题考查主族元素电子排布特征、等电子体、元素及其化合物的性质等,难度不大,注意向盛有硫酸铜溶液的试管里加入氨水的量不同,反应机理不同.

练习册系列答案
相关题目
化学与生产、生活、社会密切相关.下列有关说法中,错误的是( )
| A、服用铬含量超标的药用胶囊会对人体健康造成危害 |
| B、镀层破坏后,镀锡铁板比镀锌铁板更耐腐蚀 |
| C、关闭高能耗的化工企业,体现了“低碳经济”的宗旨 |
| D、雾霾主要是由化石燃料燃烧排放的二氧化硫、氮氧化物、烟尘以及机动车尾气、建筑扬尘等导致的 |
电解NaCl溶液的装置如图所示,下列说法不正确的是( )
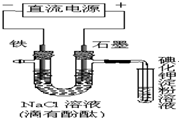

| A、铁电极上的电极反应式为Fe-2e-=Fe2+ |
| B、溶液中Na+由石墨电极向铁电极移动 |
| C、通电一段时间后,可看到铁电极附近溶液变红 |
| D、通电一段时间后,可看到试管中溶液变蓝 |
下列物质中属于非电解质的是( )
| A、H2 |
| B、氨水 |
| C、CO2 |
| D、H2SO4 |
将Cu放入0.1mol?L-1的FeCl3溶液中,反应一定时间后取出Cu,溶液中Fe2+、Fe3+的浓度比为3:2,则Cu2+和Fe3+的物质的量之比为( )
| A、3:2 | B、3:5 |
| C、4:3 | D、3:4 |
“分类”是一种思想方法,在化学发展中起到了重要作用.下列说法正确的是( )
| A、氧化还原反应中,一种元素化合价升高,一定有另一种元素化合价降低 |
| B、根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液 |
| C、根据水溶液能否导电将化合物分为电解质和非电解质 |
| D、碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物 |