题目内容
现有270g质量分数为20%的CuCl2溶液.计算
(1)溶液中CuCl2的物质的量;
(2)溶液中Cu2+和Cl-的物质的量.
(1)溶液中CuCl2的物质的量;
(2)溶液中Cu2+和Cl-的物质的量.
考点:溶液中溶质的质量分数及相关计算
专题:物质的量浓度和溶解度专题
分析:(1)根据溶液的质量和溶质的质量分数求出CuCl2的质量,再求出物质的量;
(2)根据CuCl2在溶液中电离出来的Cu2+和Cl-的数目计算物质的量.
(2)根据CuCl2在溶液中电离出来的Cu2+和Cl-的数目计算物质的量.
解答:
解:(1)现有270g质量分数为20%的CuCl2溶液,则CuCl2的质量=270g×20%=54g,
则其物质的量n=
=
=0.4mol;
答:溶液中CuCl2的物质的量为0.4mol;
(2)CuCl2在溶液中完全电离出来的Cu2+和Cl-,CuCl2=Cu2++2Cl-,
则n(Cu2+)=n(CuCl2)=0.4mol,n(Cl-)=2n(CuCl2)=0.8mol,
答:溶液中Cu2+的物质的量为0.4mol,Cl-的物质的量为0.8mol.
则其物质的量n=
| m |
| M |
| 54g |
| 135g/mol |
答:溶液中CuCl2的物质的量为0.4mol;
(2)CuCl2在溶液中完全电离出来的Cu2+和Cl-,CuCl2=Cu2++2Cl-,
则n(Cu2+)=n(CuCl2)=0.4mol,n(Cl-)=2n(CuCl2)=0.8mol,
答:溶液中Cu2+的物质的量为0.4mol,Cl-的物质的量为0.8mol.
点评:本题考查物质的量的有关计算,题目难度不大,本题注意把握有关计算公式的运用,侧重于考查学生的计算能力.

练习册系列答案
 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
设NA为阿伏加德罗常数的数值,则下列说法正确的是( )
| A、2.24 L C4H6中含有碳碳叁键数一定为0.1×6.02×1023 |
| B、在标准状态下,11.2 L NO与11.2 L O2混合后气体分子数为0.75NA |
| C、含1molFeCl3的饱和溶液滴入沸水中得到氢氧化铁胶体粒子数目为NA |
| D、120g NaHSO4固体中的离子总数为2NA |
某溶液中可能含有SO42-、CO32-、Cl-,为了检验其中是否含有SO42-,除BaCl2液外,还需要的溶液是( )
| A、H2SO4 |
| B、HCl |
| C、NaOH |
| D、NaNO3 |
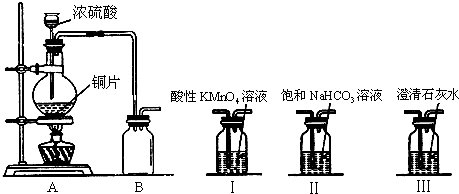
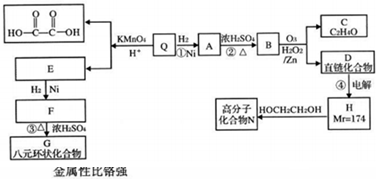
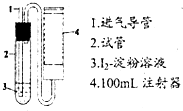 二氧化硫是造成大气污染的主要有害气体之一,某合作学习小组的同学拟测定某地大气中SO2的含量,实验步骤及装置如图:
二氧化硫是造成大气污染的主要有害气体之一,某合作学习小组的同学拟测定某地大气中SO2的含量,实验步骤及装置如图: