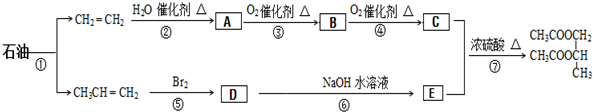
题目内容
NA表示阿伏伽德罗常数的数值,下列说法不正确的是( )
| A、将1molNH4NO3溶于一定浓度的稀氨水中,溶液呈中性,若不考虑挥发,溶液中一定含有NA个NH4 |
| B、1mol/LCH3COOH与1mol/L CH3COONa溶液等体积混合,溶液中CH3COOH和CH3COO-的总数为2NA |
| C、常温常压下,3.6g H2O中含有电子数为2NA |
| D、含有2NA个氧原子的氧气与臭氧的混合气体的质量为32g |
考点:阿伏加德罗常数
专题:
分析:A.依据溶液呈电中性,结合电荷守恒规律;
B.没指明溶液的体积,无法计算;
C.根据n=
并结合水中的电子数来分析;
D.根据氧原子的物质的量来计算.
B.没指明溶液的体积,无法计算;
C.根据n=
| m |
| M |
D.根据氧原子的物质的量来计算.
解答:
解:A.根据溶液的电中性可知:n(NH4+)+n(H+)=n(NO3-)+n(OH-),而由于溶液呈中性,可知n(H+)=n(OH-),故有n(NH4+)=n(NO3-),而n(NO3-)=1mol,故n(NH4+)=1mol,故A正确;
B.溶液的体积不知道,无法计算,故B错误;
C.3.6g H2O的物质的量n=
=
=0.2mol,而1molH2O含10mol电子,故0.2mol水中含2mol电子,个数为2NA个,故C正确;
D.氧气和臭氧均由氧原子构成,2NA个氧原子的物质的量为2mol,质量m=nM=2mol×16g/mol=32g,故D正确.
故选:B.
B.溶液的体积不知道,无法计算,故B错误;
C.3.6g H2O的物质的量n=
| m |
| M |
| 3.6g |
| 18g/mol |
D.氧气和臭氧均由氧原子构成,2NA个氧原子的物质的量为2mol,质量m=nM=2mol×16g/mol=32g,故D正确.
故选:B.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
已知2Cu(NO3)2
2CuO+4NO2↑+O2↑;已知带火星的木条在空气中不能复燃,但伸进分解产生的混合气体中,木条能复燃,分析说明( )
| ||
| A、NO2具有氧化性 |
| B、NO2具有还原性 |
| C、NO2不发生反应 |
| D、只有O2才能燃烧 |
反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g)在 5L密闭容器中进行,30秒后,NO的物质的量增加了0.3mol,则此反应的平均速率v(x)(表示反应物的消耗速率或生成物的生成速率)为( )
| A、v (O2)=0.0l mol?L-1?s-1 |
| B、v (NO)=0.001 mol?L-1?s-1 |
| C、v (NH3)=0.001 mol?L-1?s-1 |
| D、v (H2O)=0.003 mol?L-1?s-1 |
下列物质中属于非电解质的是( )
| A、H2 |
| B、氨水 |
| C、CO2 |
| D、H2SO4 |
用NA代表阿伏加德罗常数,相关说法不正确的是( )
| A、13.5 g Al与足量盐酸反应生成H2的分子数为NA |
| B、标准状况下,2.24 L CH4所含电子数为NA |
| C、500 mL 1 mol?L-1的K2SO4溶液中含有K+数目为NA |
| D、0.5 mol O2和0.5 mol O3的混合物所含有的氧原子个数为2.5NA |
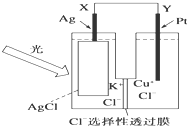 一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl(s)
一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl(s)