题目内容
15.NA表示阿伏伽德罗常数的值,则下列说法正确的是( )| A. | 7.2gC5H12含有共价键数为1.6NA | |
| B. | 14g乙烯和丙烯的混合物中含有原子的数目为NA | |
| C. | 标准状况下,224mL己烷充分燃烧后生成的CO2的分子数为0.06NA | |
| D. | 1.7g羟基(-OH)含有的电子数为NA |
分析 A、求出戊烷的物质的量,然后根据戊烷中含16条共价键来分析;
B、乙烯和丙烯的最简式均为CH2;
C、标况下己烷为液态;
D、求出羟基的物质的量,然后根据羟基中含9个电子来分析.
解答 解:A、7.2g戊烷的物质的量为n=$\frac{7.2g}{72g/mol}$=0.1mol,而戊烷中含16条共价键,故0.1mol戊烷中含1.6NA条共价键,故A正确;
B、乙烯和丙烯的最简式均为CH2,故14g混合物中含有的CH2的物质的量为1mol,则含3NA个原子,故B错误;
C、标况下己烷为液态,故不能根据气体摩尔体积来计算其物质的量,故C错误;
D、1.7g羟基的物质的量为0.1mol,而羟基中含9个电子,故0.1mol羟基中含0.9NA个电子,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.常温下在下列溶液中加入足量的铁,充分反应后,生成气体最多的是( )
| A. | 20 mL 12 mol/L的盐酸 | B. | 10 mL 18 mol/L的硫酸 | ||
| C. | 80 mL 2 mol/L的硫酸 | D. | 40 mL 14 mol/L的硝酸 |
7.${\;}_{53}^{131}$I是常规核裂变产物之一.下列有关${\;}_{53}^{131}$I的叙述中不正确的是( )
| A. | ${\;}_{53}^{131}$I的化学性质与${\;}_{53}^{127}$I相同 | |
| B. | ${\;}_{53}^{131}$I的原子序数为53 | |
| C. | ${\;}_{53}^{131}$I的原子核外电子数为78 | |
| D. | ${\;}_{53}^{131}$I的原子核内中子数多于质子数 |
4.高炉炼铁的烟尘中主要含有锌、铁、铜等金属元素.从烟尘中提取硫酸锌,可以变废为宝,减少其对环境的危害.图是用高炉烟尘制取硫酸锌的工业流程.

已知:
①20℃时,0.1mol•L-1的金属离子沉淀时的pH
②过二硫酸铵是一种强氧化剂.
③ZnSO4+4NH3=[Zn(NH3)4]SO4,[Zn(NH3)4]SO4易溶于水.
回答下列问题:
(1)为提高烟尘中金属离子的浸出率,除了适度增加硫酸浓度外,还可以采取什么措施?(举出1种)升高温度.
(2)上述流程测得溶液pH=5.0,此处可以选择的测量仪器是pH计.
(3)加入MnO2的目的是将Fe2+氧化成Fe3+.
(4)写出还原过程发生的主要反应的离子方程式Zn+Cu2+=Zn2++Cu.
(5)写出过二硫酸铵把硫酸锰(MnSO4)氧化的化学方程式MnSO4+(NH4)2S2O8+2H2O=MnO2+(NH4)2SO4+2H2SO4.
(6)操作甲中为使锌离子完全沉淀,添加的最佳试剂是C
A、锌粉 B、氨水 C、(NH4)2CO3 D、NaOH
(7)若pH=5.0时,溶液中的Cu2+尚未开始沉淀,求溶液中允许的Cu2+浓度的最大值10-1.6mol/L.

已知:
①20℃时,0.1mol•L-1的金属离子沉淀时的pH
| pH | Fe3+ | Zn2+ | Mn2+ | Cu2+ |
| 开始沉淀 | 1.9 | 6.0 | 8.1 | 4.7 |
| 沉淀完全 | 3.7 | 8.0 | 10.1 | 6.7 |
| 沉淀溶解 | 不溶解 | 10.5 | 不溶解 | / |
③ZnSO4+4NH3=[Zn(NH3)4]SO4,[Zn(NH3)4]SO4易溶于水.
回答下列问题:
(1)为提高烟尘中金属离子的浸出率,除了适度增加硫酸浓度外,还可以采取什么措施?(举出1种)升高温度.
(2)上述流程测得溶液pH=5.0,此处可以选择的测量仪器是pH计.
(3)加入MnO2的目的是将Fe2+氧化成Fe3+.
(4)写出还原过程发生的主要反应的离子方程式Zn+Cu2+=Zn2++Cu.
(5)写出过二硫酸铵把硫酸锰(MnSO4)氧化的化学方程式MnSO4+(NH4)2S2O8+2H2O=MnO2+(NH4)2SO4+2H2SO4.
(6)操作甲中为使锌离子完全沉淀,添加的最佳试剂是C
A、锌粉 B、氨水 C、(NH4)2CO3 D、NaOH
(7)若pH=5.0时,溶液中的Cu2+尚未开始沉淀,求溶液中允许的Cu2+浓度的最大值10-1.6mol/L.
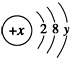 ( y≠0 ).请回答:
( y≠0 ).请回答: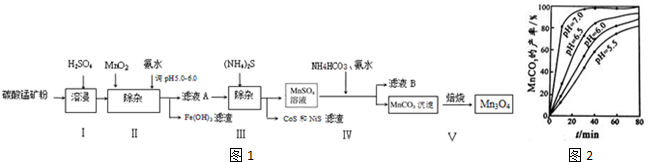
 的系统命名是2,6-二甲基辛烷
的系统命名是2,6-二甲基辛烷 的名称是1,3-二甲基苯
的名称是1,3-二甲基苯