题目内容
6.已知某微粒的结构示意图为: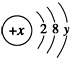 ( y≠0 ).请回答:
( y≠0 ).请回答:(1)当x-y=10时,该微粒为原子(填“原子”、“阳离子”或“阴离子”).
(2)当y=8时,微粒可能为(不少于5种)Ar、K+、Ca2+、S2-、Cl-.
(3)写出x+y=12与x+y=16的元素最高价氧化物对应水化物相互反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
分析 (1)当x-y=10时,核内的质子数等于核外的电子数;
(2)当y=8时,该微粒达8电子的稳定结构,可能为原子、阳离子或阴离子,据此分析;
(3)由于当此微粒是元素的原子时,则有x=10+y,然后结合x+y=12与x+y=16,分别求解出两种元素的种类,据此分析.
解答 解:(1)由于核外的第一层和第二层上共有10个电子,故当x-y=10时,核内的质子数等于核外的电子数,则该微粒为原子,故答案为:原子;
(2)当y=8时,该微粒达8电子的稳定结构,可能为原子、阳离子或阴离子.若为原子,则为Ar;若为阳离子,即通过失电子达到8电子稳定结构,则可以为K+、Ca2+;若为阴离子,则通过得电子达到了8电子的稳定结构,则可能为S2-、Cl-等,故答案为:K+、Ca2+、S2-、Cl-;
(3)由于当此微粒是元素的原子时,则有x=10+y,若x+y=12,则解得x=11,即此元素为钠元素,其最高价氧化物对应水化物为NaOH;若x+y=16,则解得x=13,其最高价氧化物对应水化物为Al(OH)3,则两者反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O.
点评 本题考查了根据结构示意图推导微粒的种类、并通过所给的条件来计算出元素的种类并书写化学方程式,难度不大,应注意的是符合同一个结构示意图的可能是原子,也可能是离子.

练习册系列答案
相关题目
16.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | pH=12的溶液中:K+、Na+、AlO2-、CO32- | |
| B. | 在0.1mol•L-1的NaHCO3 溶液中:K+、Al3+、I-、Cl- | |
| C. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- | |
| D. | 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- |
17.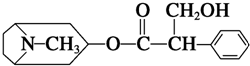 我国科学家发现金丝桃素对高致病性禽流感病毒杀灭效果良好,某种金丝桃素的结构简式如图所示:
我国科学家发现金丝桃素对高致病性禽流感病毒杀灭效果良好,某种金丝桃素的结构简式如图所示:
下列有关金丝桃素的说法:
①属于烃的衍生物,燃烧只产生CO2和H2O
②可以发生取代、加成、酯化、消去等反应
③分子式为C17H23O3N,苯环上的一氯取代物有3种
④1mol该物质最多能和4mol H2发生加成反应
其中正确的是( )
 我国科学家发现金丝桃素对高致病性禽流感病毒杀灭效果良好,某种金丝桃素的结构简式如图所示:
我国科学家发现金丝桃素对高致病性禽流感病毒杀灭效果良好,某种金丝桃素的结构简式如图所示:下列有关金丝桃素的说法:
①属于烃的衍生物,燃烧只产生CO2和H2O
②可以发生取代、加成、酯化、消去等反应
③分子式为C17H23O3N,苯环上的一氯取代物有3种
④1mol该物质最多能和4mol H2发生加成反应
其中正确的是( )
| A. | ①和④ | B. | ②和④ | C. | ②和③ | D. | ①和③ |
14.下列说法正确的是( )
| A. | 水的电离是一个吸热过程,温度升高,水的离子积KW也增大 | |
| B. | 当pH减少2个单位时,溶液中c(H+)增大20倍 | |
| C. | pH=2.0的酸溶液,稀释10倍时,pH为3 | |
| D. | 溶液稀释时,c(H+)减少,pH增大 |
1.下列关于多电子原子的核外电子运动规律的叙述正确的是( )
①核外电子是分层运动的 ②所有电子在同一区域里运动 ③能量高的电子在离核近的区域里运动 ④能量低的电子在离核近的区域里运动.
①核外电子是分层运动的 ②所有电子在同一区域里运动 ③能量高的电子在离核近的区域里运动 ④能量低的电子在离核近的区域里运动.
| A. | ①② | B. | ①④ | C. | ②③ | D. | ③④ |
11.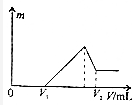 将0.1mol的镁、铝混合物溶于100mL2mol/LH2SO4溶液中,然后再滴加1mol/LNaOH溶液.若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示.当V2=460mL时,则原混合物中镁铝的质量比是( )
将0.1mol的镁、铝混合物溶于100mL2mol/LH2SO4溶液中,然后再滴加1mol/LNaOH溶液.若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示.当V2=460mL时,则原混合物中镁铝的质量比是( )
 将0.1mol的镁、铝混合物溶于100mL2mol/LH2SO4溶液中,然后再滴加1mol/LNaOH溶液.若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示.当V2=460mL时,则原混合物中镁铝的质量比是( )
将0.1mol的镁、铝混合物溶于100mL2mol/LH2SO4溶液中,然后再滴加1mol/LNaOH溶液.若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示.当V2=460mL时,则原混合物中镁铝的质量比是( )| A. | 1:1 | B. | 2:3 | C. | 16:27 | D. | 8:9 |
15.NA表示阿伏伽德罗常数的值,则下列说法正确的是( )
| A. | 7.2gC5H12含有共价键数为1.6NA | |
| B. | 14g乙烯和丙烯的混合物中含有原子的数目为NA | |
| C. | 标准状况下,224mL己烷充分燃烧后生成的CO2的分子数为0.06NA | |
| D. | 1.7g羟基(-OH)含有的电子数为NA |
16.扁桃酸甲酯是一种重要的化工产品.其结构如图所示,下列有关扁桃酸甲酯的说法中不正确的是( )
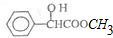
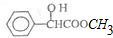
| A. | 分子式为C9H10O3 | |
| B. | 可以发生取代反应、加成反应、氧化反应和还原反应 | |
| C. | 1mol该物质最多可与4mol H2发生加成反应 | |
| D. | 其苯环上的二氯代物共有六种结构 |
 a、b、c、d是四种原子序数依次增大的短周期元素.a原子的电子层数为n,核内质子数是2n2-1,最外层电子数为2n+l;b、d同主族,能形成两种中学常见的化合物;c与b组成的化合物是一种两性氧化物,工业上通过电解该化合物可冶炼c单质;e原子有四个能层,其未成对电子数在同周期是最多的.回答下列问题:
a、b、c、d是四种原子序数依次增大的短周期元素.a原子的电子层数为n,核内质子数是2n2-1,最外层电子数为2n+l;b、d同主族,能形成两种中学常见的化合物;c与b组成的化合物是一种两性氧化物,工业上通过电解该化合物可冶炼c单质;e原子有四个能层,其未成对电子数在同周期是最多的.回答下列问题: