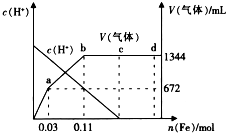
题目内容
16.下列与化学概念有关的说法正确的是( )| A. | CO2、SO2都是酸性氧化物 | |
| B. | 盐类物质一定含有金属离子 | |
| C. | H2O、HCOOH、(NH4)2Fe(SO4)2中均含有氧元素,都是氧化物 | |
| D. | 凡能电离出H+的化合物均属酸 |
分析 A.能与碱反应的氧化物是酸性氧化物,CO2、SO2都是酸性氧化物;
B.铵盐不含金属离子;
C.根据氧化物的定义分析,氧化物含有两种元素,一种元素是氧元素;
D.电离产生阳离子都是氢离子的是酸.
解答 解:A.CO2、SO2都能和碱反应生成盐和水,CO2、SO2都是酸性氧化物,如:二氧化硫和KOH反应生成亚硫酸钠和水,离子方程式为SO2+2OH-=SO32-+H2O,故A正确;
B.铵盐属于盐,但不含金属离子,故B错误;
C.含有氧元素的化合物不一定是氧化物,氧化物含有两种元素,H2O是氧化物,HCOOH、(NH4)2Fe(SO4)2中虽均含有氧元素,但都含有两种以上元素,所以都不是氧化物,故C错误;
D.能电离出H+的化合物不一定属酸,如:硫酸氢钠电离生成钠离子、氢离子、硫酸根离子,但是属于盐,故D错误;
故选A.
点评 本题考查了酸碱盐概念分析判断,熟悉相关概念是解题关键,注意酸、碱、盐概念的理解,题目难度不大..

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
6.下列图示与对应的叙述相符的是( )
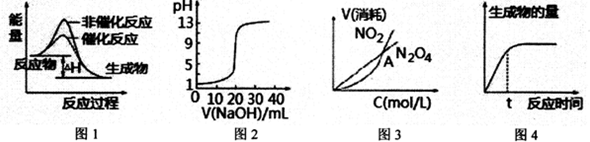

| A. | 图l表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| B. | 图2表示0.1000mol•L-1NaOH溶液滴定20.00mL0.1 000mol•L-1 CH3COOH溶液所得到的滴定曲线 | |
| C. | 图3表示恒温恒容条件下,2NO2(g)?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| D. | 图4表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时v正>v逆 |
4.下列状态的物质,既能导电又属于电解质的是( )
| A. | 熔融的KOH | B. | NaCl溶液 | C. | 液态HCl | D. | MgCl2晶体 |
11.根据表中信息判断,下列选项不正确的是( )
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4 |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4- Cl- | Cl2、Mn2+ |
| A. | 第①组反应的其余产物为H2O和 O2 | |
| B. | 第②组反应从产物结果可以得出还原性顺序:Fe2+>Br- | |
| C. | 第③组反应中生成1mol Cl2,转移电子数为2NA | |
| D. | 氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Br2 |
1.氧化还原反应与四种基本反应类型反应的关系如图所示,则下列化学反应属于区域3的是( )

| A. | Zn+H2SO4═ZnSO4+H2↑ | B. | 3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$3CO2+2Fe | ||
| C. | CaO+H2O═Ca(OH)2 | D. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ |
8.下列各组物质,前者属于电解质,后者属于电解质的是( )
| A. | NaCl晶体、铜 | B. | 稀硫酸、二氧化硫 | C. | 液态的醋酸、液氨 | D. | 熔融的KNO3、硝酸 |
5.化学知识在生产和生活中有着重要的应用.下列说法中,错误的是( )
| A. | 与铜质水龙头连接处的钢质水管易发生腐蚀 | |
| B. | 明矾常作为净水剂,双氧水通常可用于作杀菌消毒 | |
| C. | 金属钠、镁等活泼金属着火时,可以使用泡沫灭火器来灭火 | |
| D. | 发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔 |
6.密闭容器中盛有一定量的CH4与O2混合气体及足量的Na2O2固体,电火花点燃充分反应后,恢复至室温,发现容器为真空,则原混合气中CH4与O2的体积比为( )
| A. | 2:1 | B. | 1:2 | C. | 1:1 | D. | 任意比 |
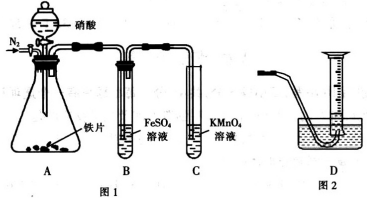 为探究铁和稀硝酸反应的产物,某兴趣小组进行如下实验.
为探究铁和稀硝酸反应的产物,某兴趣小组进行如下实验.