题目内容
11.将标准状况下体积为2.24L的H2S缓慢通入100rnl 1.5mol/LNaOH溶液中(溶液体积变化忽略不计)充分反应后,下列关系式中错误的是( )| A. | c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-) | B. | c(Na+)>c(HS-)>c(S2-)>c(H+)>c(OH-) | ||
| C. | c(Na+)>c(HS-)+c(S2-)+c( H2S) | D. | c(HS-)+c(S2-)+c(H2S)=1.0mol•L-1 |
分析 n(H2S)=$\frac{2.24L}{22.4L/mol}$=0.1mol,n(NaOH)=0.1L×1.5mol/L=0.15mol,n(H2S):n(NaOH)=0.1mol:0.15mol=2:3,2H2S+3OH-=S2-+HS-+H2O,S2-水解程度大于HS-,结合溶液的电中性原则、物料守恒以及质子守恒解答该题.
解答 解:A.溶液存在电荷守恒,则应有c(Na+)+c(H+)=c(HS-)+2 c(S2-)+c(OH-),故A正确;
B.硫化钠和硫氢化钠混合溶液呈碱性,则c(OH-)>c(H+),故B错误;
C.根据物料守恒得2c(Na+)=3[c(HS-)+c(S2-)+c(H2S)],所以c(Na+)>[c(HS-)+c(S2-)+c(H2S)],故C正确;
D.根据物料守恒得c(HS-)+c(S2-)+c(H2S)=1.0mol/L,故D正确;
故选B.
点评 本题考查离子浓度大小比较,题目难度中等,本题注意根据反应物的物质的量判断反应物,比较离子浓度大小关系时,常常用到电荷守恒、物料守恒以及质子守恒等方法,做题时注意体会.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.在下列溶液中通入CO2气体至过量,原溶液最终出现浑浊状态的是( )
| A. | 澄清石灰水 | B. | 氢氧化钡溶液 | C. | 氯化钙溶液 | D. | 饱和碳酸钠溶液 |
2.下列实验操作中错误的是( )
| A. | 过滤时,玻璃棒的末端应轻轻靠在三层滤纸上 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 称氢氧化钠时,不能直接称量,要放在纸片上称量 |
19.在Ca(OH)2(Ksp=5.5×10-6)、Mg(OH)2(Ksp=1.2×10-11)、AgCl(Ksp=1.56×10-10)三种物质中,下列说法正确的是( )
| A. | Mg(OH)2的溶解度最小 | B. | Ca(OH)2的溶解度最小 | ||
| C. | AgCl的溶解度最小 | D. | 相同条件下Ksp越小的溶解度越大 |
6.水体污染加剧水资源短缺,严重危害人体健康.下列关于水污染的描述中不正确的是( )
| A. | 水俣病是由汞等重金属污染水体而造成的 | |
| B. | “赤潮”和“水华”是由水体富营养化而形成的 | |
| C. | 海湾战争期间波斯湾严重的石油泄漏事件是人类历史上一次灾难性的水体污染事件 | |
| D. | 化肥和农药的广泛使用可以促进农产品增产,不会造成水体污染 |
16.一定条件下反应A(g)+B(g)?C(g)△H<0达到平衡后,据下列图象判断:
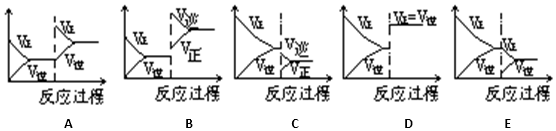

| 达到新的平衡对应的图象 (填写字母) | 平衡移动方向 (正反应、逆反应,不移动) | |
| (1)使用催化剂 | ||
| (2)升温 | ||
| (3)降压 | ||
| (4)增加A的量 | ||
| (5)减少C的量 |
3.FeCl3溶液、Fe(OH)3胶体、Fe(OH)3浊液是三种重要的分散系,下列叙述中不正确的是( )
| A. | Fe(OH)3胶体区别于其他分散系的本质特征是分散质粒子的直径在10-9~10-7米之间 | |
| B. | 分别用一束光透过三种分散系,只有Fe(OH)3胶体具有丁达尔效应 | |
| C. | 往FeCl3溶液中加入NaOH溶液,并适当加热,可制得Fe(OH)3胶体 | |
| D. | 三种分散系中分散质均属于电解质 |
18.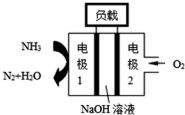 (1)已知在2L的容器中进行下列可逆反应,各物质的有关数据如下:
(1)已知在2L的容器中进行下列可逆反应,各物质的有关数据如下:
aA (g)+bB (g)?2C(g)
则:①该可逆反应的化学方程式可表示为3A(g)+B(g)?2C(g);
②0到2s用物质B来表示的反应速率为0.1mol/(L•s);
③从反应开始到2s末,A的转化率为40%;
④下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是BE.
A.vB(反应)=vC(生成) B.容器内气体的总压强保持不变
C.容器内气体的密度不变 D.vA:vB:vC=3:2:2
E.容器内气体C的物质的量分数保持不变
(2)①锌电池有望代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应式是:2Zn+O2=2ZnO.则该电池的负极材料是锌;
②瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如图,该燃料电池工作时,电池的总反应为4NH3+3O2=2N2+6H2O;负极的电极反应为2NH3-6e-+6OH-═N2+6H2O.
 (1)已知在2L的容器中进行下列可逆反应,各物质的有关数据如下:
(1)已知在2L的容器中进行下列可逆反应,各物质的有关数据如下:aA (g)+bB (g)?2C(g)
| 起始物质的量浓度(mol/L) | 1.5 | 1 | 0 |
| 2s末物质的量浓度(mol/L) | 0.9 | 0.8 | 0.4 |
②0到2s用物质B来表示的反应速率为0.1mol/(L•s);
③从反应开始到2s末,A的转化率为40%;
④下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是BE.
A.vB(反应)=vC(生成) B.容器内气体的总压强保持不变
C.容器内气体的密度不变 D.vA:vB:vC=3:2:2
E.容器内气体C的物质的量分数保持不变
(2)①锌电池有望代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应式是:2Zn+O2=2ZnO.则该电池的负极材料是锌;
②瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如图,该燃料电池工作时,电池的总反应为4NH3+3O2=2N2+6H2O;负极的电极反应为2NH3-6e-+6OH-═N2+6H2O.