题目内容
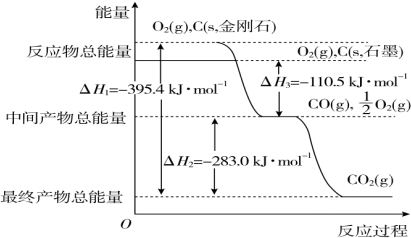
6. 常温下,向25mL 0.1mol•L-1 MOH 溶液中逐滴加入0.2mol•L-1 HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:
常温下,向25mL 0.1mol•L-1 MOH 溶液中逐滴加入0.2mol•L-1 HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:(1)MOH与HA恰好完全反应时,溶液呈碱性(填“酸”、“碱”或“中”),用离子方程式表示其原因A-+H2O?HA+OH-.此时,混合溶液中由水电离出的c(H+)> 0.2mol.L-1 HA溶液中由水电离出的c(H+)(填“>”“<”或“=”).
(2)D点时,溶液中c(A-)+c(HA)=2c(M+)(填“>”“<”或“=”);若此时测得混合溶液的pH=3,则 c(HA)+c(H+)=0.05+10-11 mol•L-1(数字表达式,不必具体算出结果).
(3)分别写出C点混合溶液中各离子浓度的大小关系c(A-)>c(M+)>c(H+)>c(OH-).
分析 (1)由图象可知,当加入13mL 0.2mol/L HA溶液时,n(HA)=0.0026mol,而n(MOH)=0.0025mol,说明HA过量,但溶液呈中性,说明HA为弱酸,如二者恰好反应,应生成强碱弱酸盐,促进水的电离;
(2)结合电荷守恒和物料守恒解答;
(3)C点混合溶液显示酸性,得到的溶液是MA和HA,据此回答.
解答 解:(1)由图象可知,当加入13mL 0.2mol/L HA溶液时,n(HA)=0.0026mol,而n(MOH)=0.0025mol,说明HA过量,但溶液呈中性,说明HA为弱酸,如二者恰好反应,应生成强碱弱酸盐,水解呈碱性,发生A-+H2O?HA+OH-,促进水的电离,则混合溶液中由水电离出的c(H+)大于0.2mol/L HA溶液中由水电离出的c(H+),
故答案为:碱;A-+H2O?HA+OH-;>;
(2)D点时,加入n(HA)=0.005mol,而加入n(MOH)=0.0025mol,A元素以A-和HA两种形式存在,而M全以M+形式存在,溶液中c(A-)+c(HA)=2c(M+);
c(M+)=0.05mol/L,c(OH-)=1×10-11mol/L,由电荷守恒c(M+)+c(H+)=c(A-)+c(OH-)和物料守恒c(A-)+c(HA)=2c(M+)可得:c(HA)+c(H+)=c(M+)+c(OH-)=0.05mol/L+10-11mol/L,
故答案为:=;0.05+10-11;
(3)C点混合溶液显示酸性,得到的溶液是MA和HA,存在:c(A-)>c(M+)>c(H+)>c(OH-),故答案为:c(A-)>c(M+)>c(H+)>c(OH-).
点评 本题考查了酸碱混合溶液定性判断,题目难度中等,试题侧重于学生的分析能力的考查,为高考常见题型,明确图象中各个点的含义是解本题关键,结合电荷守恒、物料守恒来分析解答,注意溶液的导电能力与离子浓度的关系.

CrO42-$→_{①转化}^{H+}$Cr2O72-$→_{②还原}^{Fe_{2}+}$Cr3+$→_{③沉淀}^{OH-}$Cr(OH)3↓
已知转化过程中的反应为2CrO42-(aq)+2H+(aq)═Cr2O72-(aq)+H2O(l).转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是( )
| A. | 溶液颜色保持不变,说明上述可逆反应达到平衡状态 | |
| B. | 若用绿矾(FeSO4•7H2O)作还原剂,处理1L废水,至少需要917.4 g | |
| C. | 常温下转化反应的平衡常数K=l×1014.则转化后所得溶液的pH=6 | |
| D. | 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+ )降至1×10-5mol/L,应调溶液的pH=5 |
| A. | 澄清石灰水 | B. | 氢氧化钡溶液 | C. | 氯化钙溶液 | D. | 饱和碳酸钠溶液 |
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
| NH3的浓度(mol•L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | a1 | a2 | a3 |
| A. | α1+α3<1 | B. | a+b>92.4 | C. | 2p2<p3 | D. | 2c1>c3 |
| A. | AlCl3与NH3•H2O | B. | NaOH、MgSO4 | C. | Al2(SO4)3、NaOH | D. | BaCl2、H2SO4 |
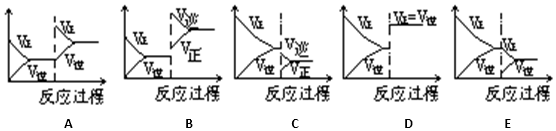
| 达到新的平衡对应的图象 (填写字母) | 平衡移动方向 (正反应、逆反应,不移动) | |
| (1)使用催化剂 | ||
| (2)升温 | ||
| (3)降压 | ||
| (4)增加A的量 | ||
| (5)减少C的量 |