��Ŀ����
12�����Ṥҵ��SO2ת��ΪSO3����Ҫ�ķ�Ӧ֮һ����һ��ѹǿ�ʹ�����������2L�ܱ������г���0.8molSO2��2molO2������Ӧ��2SO2��g��+O2��g��$?_{����}^{����}$2SO3��g����SO2��ת�������¶ȵı仯�����ʾ��| �¶ȡ� | 450 | 500 | 550 | 600 |
| SO2��ת����% | 97.5 | 95.8 | 90.50 | 80.0 |
��2�����жϸ÷�Ӧ�Ƿ�ﵽƽ��״̬����ACF
A��������ѹǿ���� B�����������ܶȲ���
C�����������SO3��Ũ�Ȳ��� D��C��SO2��=C��SO3��
E��V����SO2��=V����SO3�� F��V����SO3��=2V�棨O2��
��3��ij�¶��¾�2min��Ӧ�ﵽƽ���C��SO2��=0.08mol•L-1��
��0��2min֮�䣬O2�ķ�Ӧ����Ϊ0.08mol•L-1•min-1��
�ڴ�ʱ���¶�Ϊ600�森
�۴��¶��µ�ƽ�ⳣ��Ϊ$\frac{400}{21}$�����÷�����ʾ����
��4������ƽ�ⷴӦ������ѹǿ����������ɱ䣩��ƽ�⽫�����ƶ���
���� ��1�������¶ȣ����淴Ӧ�����ȷ�Ӧ�����ƶ�������ƽ�ⳣ�����¶ȱ仯��ϵȷ���ʱ䣻
��2������Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ�Ũ�ȡ��ٷֺ������䣬�Լ��ɴ�������һЩ��Ҳ�������仯���ݴ˽�𣬽���ʱҪע�⣬ѡ���жϵ������������ŷ�Ӧ�Ľ��з����仯�������������ɱ仯����ֵʱ��˵�����淴Ӧ����ƽ��״̬��
��3������ƽ��ʱ����ֵ�ƽ��Ũ�ȣ�����ƽ�ⳣ������ʽ���㣻
��4��ѹǿ����ƽ��������������ٵķ����ƶ���
��� �⣺��1�������¶ȣ�ƽ�������ȷ����ƶ������ݱ���֪���¶�Խ�ߣ���ѧƽ�ⳣ��ԽС��˵��ƽ�����淴Ӧ�����ƶ�����������Ӧ�Ƿ��ȷ�Ӧ������H��0��
�ʴ�Ϊ������
��2��A���淴Ӧ������������ʵ������٣�ѹǿ���٣�������ѹǿ���䣬˵������ƽ��״̬����A��ȷ��
B���淴Ӧ����������������䣬���������Ҳ���䣬�ܶȲ��䣬���������ܶȲ��䣬����˵������ƽ��״̬����B����
C�����������SO3��Ũ�Ȳ��䣬��˵������ƽ��״̬����C��ȷ��
D����Ӧ����ƽ��ʱ�����ʵ�Ũ�Ȳ��䣬����һ��C��SO2��=C��SO3�������Բ�����Ϊ��ƽ��״̬�ı�־����D����
E�����κ�ʱ��v����SO2��=v����SO3�������Բ�����Ϊ��ƽ��״̬�ı�־����E����
F��v����SO3��=2v����O2����ͬ���ʱ�ʾ������֮�ȵ��ڻ�ѧ������֮�ȣ�˵������ƽ��״̬����F��ȷ��
��ѡ��ACF��
��3��2SO2��g��+O2��g��?2SO3��g����
��Ӧ��ʼ��mol/L�� 0.4 1 0
��Ӧ��mol/L�� 0.32 0.16 0.32
ƽ�� ��mol/L�� 0.08 0.84 0.32
ƽ�ⳣ��K=$\frac{0.3{2}^{2}}{0.0{8}^{2}��0.84}$=$\frac{400}{21}$��
�ʴ�Ϊ��$\frac{400}{21}$��
��4���÷�Ӧ������һ������������ٵķ�Ӧ������ѹǿ����ƽ��������Ӧ�����ƶ����ʴ�Ϊ������
���� ���⿼����Ӱ�컯ѧƽ���ƶ������ء�ƽ��״̬���жϡ���Ӧ���ʵļ��㡢ƽ�ⳣ���ļ����֪ʶ�㣬ע����������ʽ����ƽ��ʱ����ֵ�ƽ��Ũ�ȣ�����ƽ�ⳣ������ʽ���㣮

 �����ѣ�CH3OCH3����һ��Ӧ��ǰ�����������ȼ�ϣ���CO��H2Ϊԭ��������������Ҫ��������������Ӧ��
�����ѣ�CH3OCH3����һ��Ӧ��ǰ�����������ȼ�ϣ���CO��H2Ϊԭ��������������Ҫ��������������Ӧ��| ��� | �Ȼ�ѧ����ʽ | ��ѧƽ�ⳣ�� |
| �� | CO��g��+2H2��g��?CH3OH��g����H1 | K1 |
| �� | 2CH3OH��g��?CH3OCH3��g��+H2O��g����H2=-24kJ•mol-1 | K2 |
| �� | CO��g��+H2O��g��?CO2��g��+H2��g����H3=-41kJ•mol-1 | K3 |
��1����֪��Ӧ���е���صĻ�ѧ�������������£�
| ��ѧ�� | H-H | C-O | C=O | H-O | C-H |
| E/��kJ��mol-1�� | 436 | 343 | 1076 | 465 | 413 |
��2���ù��յ��ܷ�ӦΪ3CO��g��+3H2��g��?CH3OCH3��g��+CO2��g����H
�÷�Ӧ��H=-263 kJ•mol-1����ѧƽ�ⳣ��K=K12•K2•K3���ú�K1��K2��K3�Ĵ���ʽ��ʾ����
��3�����д�ʩ�У������CH3OCH3���ʵ���AD��
A������������� B�������¶�
C�����ø�Ч���� D������ѹǿ
��4�������з�Ӧ�ٺͷ�Ӧ�ڷֱ��ڲ�ͬ�ķ�Ӧ���н��У���Ӧ�۷������ù����з�Ӧ�۵ķ��������CH3OCH3�IJ��ʣ�ԭ���Ƿ�Ӧ�������˷�Ӧ���еIJ���H2O��ʹ��Ӧ�ڵĻ�ѧƽ��������Ӧ�����ƶ����Ӷ����CH3OCH3�IJ��ʣ�
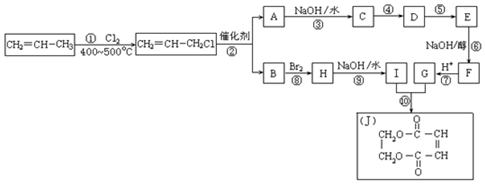
��5����$\frac{n��{H}_{2}��}{n��CO��}$=2 ͨ��1L�ķ�Ӧ���У�һ�������·�����Ӧ��4H2��g��+2CO��g��?CH3OCH3��g��+H2O��g����H����CO��ƽ��ת�������¶ȡ�ѹǿ�仯��ϵ��ͼ��ʾ������˵����ȷ����CD��
A���÷�Ӧ�ġ�H��0
B������p2��316��ʱ��Ӧ�ﵽƽ�⣬��CO��ת����С��50%
C������p3��316��ʱ��Ӧ�ﵽƽ�⣬H2��ת���ʵ���50%
D������p3��316��ʱ����ʼʱ$\frac{n��{H}_{2}��}{n��CO��}$=3�����ƽ��ʱCO��ת���ʴ���50%
E������p1��200��ʱ����Ӧ��ƽ����¶Ⱥ�ѹǿ���䣬�ٳ���2mol H2��1mol CO����ƽ��ʱ�����ѵ������������
��6��ij�¶��£���8.0mol H2��4.0mol CO�����ݻ�Ϊ2L���ܱ������У�������Ӧ��4H2��g��+2CO��g��?CH3OCH3��g��+H2O��g������Ӧ��ƽ����ö����ѵ��������Ϊ25%������¶��·�Ӧ��ƽ�ⳣ��K=2.25��
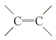 �����Ż�λ�ķ�Ӧ����������ϩ���ӽ���ϩ����λ�����ɶ�ϩ����ϩ��
�����Ż�λ�ķ�Ӧ����������ϩ���ӽ���ϩ����λ�����ɶ�ϩ����ϩ�� ��
��