题目内容
5.“可燃冰”是天然气与水相互作用形成的晶体物质,主要存在于冻土层和海底大陆架中.据测定每0.1mL固体“可燃冰”能释放出20mL甲烷气体,则下列说法中不正确的是( )| A. | “可燃冰”释放的甲烷属于烃 | |
| B. | “可燃冰”的分解与释放,可能会诱发海底地质灾害,加重温室效应 | |
| C. | “可燃冰”将成为人类的后续能源 | |
| D. | “可燃冰”是水变的油 |
分析 可燃冰的主要成分为甲烷,为良好的有机燃料,结合化学反应的特点解答该题.
解答 解:A.“可燃冰”释放出甲烷,甲烷属于烃,故A正确;
B.甲烷燃烧能生成二氧化碳,二氧化碳能引起温室效应,且甲烷可导致温室效应,故B正确;
C.由题意可知,“可燃冰”将成为人类的后继能源,故C正确;
D.可燃冰是天然气与水的混合物,水不能变为油,故D错误.
故选D.
点评 本题考查物质的组成、性质以及用途,为高频考点,主要是考查学生信息提炼、加工、运用能力,深入理解、分析信息、挖掘潜在信息知识是解题的关键,难度不大.

练习册系列答案
相关题目
15.下列说法不正确的是( )
| A. | 互为同系物的有机物其组成元素相同,且结构必须相似 | |
| B. | 正戊烷分子中所有碳原子均在一条直线上 | |
| C. | 分子式为C3H8与C6H14的两种有机物一定互为同系物 | |
| D. | 互为同系物的有机物其相对分子质量数值一定相差14 n(n为正整数) |
13.已知在酸性溶液中,下列物质氧化 KI 时,自身发生如下变化:
ClO3-→Cl-;MnO4-→Mn2+;Cl2→2Cl-;Fe3+→Fe2+.
如果分别用这些物质氧化的 KI生成等量的 I2,消耗他们物质的量最少的是( )
ClO3-→Cl-;MnO4-→Mn2+;Cl2→2Cl-;Fe3+→Fe2+.
如果分别用这些物质氧化的 KI生成等量的 I2,消耗他们物质的量最少的是( )
| A. | ClO3- | B. | MnO4- | C. | Cl2 | D. | Fe3+ |
20.下列操作,对实验现象的描述,或由现象作出的判断错误的是( )
| A. | 向溶解有Na2O2的水溶液中滴入2滴酚酞试液,溶液先变红振荡后褪色 | |
| B. | 氯气的性质活泼,它与氢气混合后立即发生爆炸 | |
| C. | 铁在纯氧中燃烧或高温下和水蒸气反应均能得到黑色Fe3O4 | |
| D. | 新制的氯水加入有色布条褪色,说明溶液中有Cl2存在 |
10.已知:将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生.若再加入双氧水,将发生反应:H2O2+2H++2I-→2H2O+I2,且生成的I2立即与试剂X反应而被消耗.一段时间后,试剂X将被反应生成的I2完全消耗.由于溶液中的I-继续被H2O2氧化,生成的I2与淀粉作用,溶液立即变蓝.因此,根据试剂X的量.滴入双氧水至溶液变蓝所需的时间,即可推算反应H2O2+2H++2I-→2H2O+I2的反应速率.
如表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
回答下列问题:
(1)已知:实验1.2的目的是探究H2O2浓度对H2O2+2H++2I-→2H2O+I2反应速率的影响.实验2中m=20.0,n=20.0
(2)一定温度下,H2O2+2H++2I-→2H2O+I2反应速率可以表示为v=k•ca(H2O2)•cb (I-)•c(H+)(k为常数),则:
①实验4时,烧杯中溶液开始变蓝的时间t=1.4min.
②根据上表数据可知,a.b的值依次为1和1.
(3)实验5表明:硫酸铁能提高反应速率.
①催化剂能加快反应速率是因为催化剂降低(填“提高”或“降低”)了反应活化能.
②试用离子方程式表示Fe2(SO4)3对H2O2+2H++2I-→2H2O+I2催化的过程.(不必配平)
如表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
| 编 号 | 往烧杯中加入的试剂及其用量(mL) | 催化剂 | 溶液开始变蓝时间(min) | ||||
| 0.1mol•L-1KI溶液 | 0.1mol•L-1H2O | X 0.1mol•L-1溶液 | 0.1mol•L-1双氧水 | 0.1mol•L-1稀盐酸 | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 无 | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | 无 | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 无 | 2.8 |
| 4 | 20.0 | 0 | 10.0 | 10.0 | 40.0 | 无 | t |
| 5 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
(1)已知:实验1.2的目的是探究H2O2浓度对H2O2+2H++2I-→2H2O+I2反应速率的影响.实验2中m=20.0,n=20.0
(2)一定温度下,H2O2+2H++2I-→2H2O+I2反应速率可以表示为v=k•ca(H2O2)•cb (I-)•c(H+)(k为常数),则:
①实验4时,烧杯中溶液开始变蓝的时间t=1.4min.
②根据上表数据可知,a.b的值依次为1和1.
(3)实验5表明:硫酸铁能提高反应速率.
①催化剂能加快反应速率是因为催化剂降低(填“提高”或“降低”)了反应活化能.
②试用离子方程式表示Fe2(SO4)3对H2O2+2H++2I-→2H2O+I2催化的过程.(不必配平)
15.如表列出了①~⑧八种元素在周期表中的位置:
请按要求回答下列问题:
(1)②、③、④三种元素的最高价氧化物对应的水化物,其中碱性最强的是NaOH(填写化学式).
(2)②、③、⑥三种元素按原子半径由大到小的顺序排列为K>Na>Mg(用元素符号表示).
(3)元素①的气态氢化物的电子式是 .写出实验室里制取该气体的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
.写出实验室里制取该气体的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(4)元素⑨的原子结构示意图是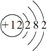 .
.
元素⑤的单质的导电性介于导体和绝缘体之间,因此是一种良好的半导体材料.
(5)向元素②的单质与水反应后的溶液中加入元素④的单质,发生反应的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑.
(6)用离子方程式证明⑦⑧两元素非金属性的强弱Cl2+2Brˉ═Br2+2Clˉ.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | |||||||
| 3 | ② | ③ | ④ | ⑤ | ⑦ | |||
| 4 | ⑥ | ⑧ |
(1)②、③、④三种元素的最高价氧化物对应的水化物,其中碱性最强的是NaOH(填写化学式).
(2)②、③、⑥三种元素按原子半径由大到小的顺序排列为K>Na>Mg(用元素符号表示).
(3)元素①的气态氢化物的电子式是
 .写出实验室里制取该气体的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
.写出实验室里制取该气体的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.(4)元素⑨的原子结构示意图是
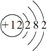 .
.元素⑤的单质的导电性介于导体和绝缘体之间,因此是一种良好的半导体材料.
(5)向元素②的单质与水反应后的溶液中加入元素④的单质,发生反应的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑.
(6)用离子方程式证明⑦⑧两元素非金属性的强弱Cl2+2Brˉ═Br2+2Clˉ.

 .
. .
. .
. .
. (写结构简式):
(写结构简式):