题目内容
14.酯类物质M是一种药物的主要合成中间体,其合成路线如下:
已知以下信息:
①芳香烃A的相对分子质量在100-110之间,1molA完全燃烧可消耗10molO2.
②H的核磁共振氢谱显示其有3种氢.
③RCH=CH2$→_{催化剂}^{HCl}$RCHClCH3
④RX+Mg$\stackrel{乙醚}{→}$RMgX(X代表卤素)
⑤

回答下列问题:
(1)A的结构简式为
 ,H中官能团的名称为羧基、硝基.
,H中官能团的名称为羧基、硝基.(2)由E和H生成M的化学方程式为
 +
+ $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$ +H2O.
+H2O.(3)属于氧化反应的是③⑥(填序号).
(4)同时符合下列条件的E的同分异构体有6种(不考虑立体异构),其中苯环上一氯代物只有两种的结构简式为
 、
、 .(任写一种)
.(任写一种)①能与碳酸钠溶液发生反应;②苯环上的取代基数目有2个,
(5)请结合所给信息,由苯合成苯乙烯,合成路线如图所示,请回答下列问题.

试剂②为CH3CHO,最后一步反应的化学方程式为
 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O.
分析 芳香烃A的相对分子质量在100~110之间,1molA完全燃烧可消耗10molO2,设A的分子式为CxHy,则x+$\frac{y}{4}$=10,$\left\{\begin{array}{l}{y=4}\\{x=9}\end{array}\right.$(舍弃)、$\left\{\begin{array}{l}{y=8}\\{x=8}\end{array}\right.$(满足条件)、$\left\{\begin{array}{l}{y=12}\\{y=7}\end{array}\right.(舍弃)$,所以A的分子式为C8H8,A能够与HCl发生加成反应生成B,则A的结构简式为 ;根据信息③可知B的结构简式为
;根据信息③可知B的结构简式为 ,B在氢氧化钠的水溶液中加热生成C,则C为
,B在氢氧化钠的水溶液中加热生成C,则C为 ,C催化氧化生成D,则D为
,C催化氧化生成D,则D为 ,结合信息⑤可知E为
,结合信息⑤可知E为 ;F发生硝化反应生成G,G被酸性高锰酸钾溶液氧化生成H,H的核磁共振氢谱表明有3种不同化学环境的氢,则H为
;F发生硝化反应生成G,G被酸性高锰酸钾溶液氧化生成H,H的核磁共振氢谱表明有3种不同化学环境的氢,则H为 、G为
、G为 、A为
、A为 ,H与E发生酯化反应生成M,则M为
,H与E发生酯化反应生成M,则M为 ,以此解答该题.
,以此解答该题.
解答 解:(1)根据分析可知,A的结构简式为: ,H为
,H为 ,含有羧基和硝基,故答案为:
,含有羧基和硝基,故答案为: ;羧基、硝基;
;羧基、硝基;
(2)由E和H生成M的化学方程式为: +
+ $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$ +H2O,
+H2O,
故答案为: +
+ $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$ +H2O;
+H2O;
(3)根据流程可知,反应①为加成反应,反应②为取代反应,反应③为氧化反应,反应④为加成反应,反应⑤为取代反应,反应⑥为氧化反应,反应⑦为酯化反应,也属于取代反应,
故答案为:③⑥;
(4)E的结构简式为 ,①能与碳酸钠溶液发生反应,说明该有机物分子中含有酚羟基;②苯环上有两个取代基,则满足条件的有机物分子中苯环上连接的两个侧链可能为:-OH和-CH2CH2CH3、-OH和,CH(CH3)2,总共有2种情况,每种含有邻、间、对三种同分异构体,属于满足条件的结构简式种类为:2×3=6;其中苯环上一氯代物只有两种,说明其具有对称结构,满足条件的结构简式为:
,①能与碳酸钠溶液发生反应,说明该有机物分子中含有酚羟基;②苯环上有两个取代基,则满足条件的有机物分子中苯环上连接的两个侧链可能为:-OH和-CH2CH2CH3、-OH和,CH(CH3)2,总共有2种情况,每种含有邻、间、对三种同分异构体,属于满足条件的结构简式种类为:2×3=6;其中苯环上一氯代物只有两种,说明其具有对称结构,满足条件的结构简式为: 、
、 ,
,
故答案为:6; 、
、 ;
;
(5)由题给信息可知试剂②为CH3CHO,最后一步发生消去反应,反应的化学方程式为 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O,
+H2O,
故答案为:CH3CHO; $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O.
点评 本题考查有机合成,综合分析确定A的结构简式为解答关键,较好的考查学生分析推理能力,是对有机化合物知识的综合考查,需要学生熟练掌握官能团的性质与转化,难度中等.

 能力评价系列答案
能力评价系列答案| A. | 为避免废旧电池中重金属对环境的污染,可将其深埋 | |
| B. | 为防止海鲜产品腐烂,可将其浸泡在甲醛溶液中 | |
| C. | 利用太阳能代替化石燃料,可改善空气质量 | |
| D. | 利用催化剂可将汽车尾气全部转化为无害气体 |
| 选项 | 实验器材 | 相应实验 |
| A | 试管、铁架台、导管、酒精灯 | 乙酸乙酯的制备 |
| B | 锥形瓶、漏斗、双孔塞、导管、带余烬的木条、药匙 | 检验MnO2对H2O2分解速率的影响 |
| C | 500mL容量瓶、烧杯、玻璃棒、天平 | 配制 500mL1.00mol/LNaCl溶液 |
| D | 三脚架、坩埚、酒精灯、坩埚钳 | 钠在空气中燃烧 |
| A. | A | B. | B | C. | C | D. | D |
(1)Na2O2作供氧剂时,主要与人呼出的CO2反应,写出该反应的化学方程式,并用双线桥标明电子转移的方向和数目
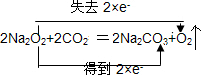 .
.(2)航空和水下作业有时也会产生污染性气体,某学习小组欲探究Na2o2能否完全吸收氮氧化物、硫氧化物等污染性气体,设计了如下装置(未画完):
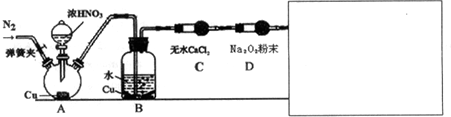
【资料信息】①酸性条件下,NO和NO2都能与MnO4-(H+)反应生成NO3-和Mn2+
②稀硝酸与Cu反应缓慢 ③2NO+Na2O2=2NaNO2
请在答题卷方框内补充完整装置示意图,并做必要标注.补充装置的作用是检验污染气体是否完全被Na2O2吸收,同时可防止污染气体排放到空气中.
(3)该学习小组中甲、乙、丙三位同学设计实验如下,完成表中空格(乙和丙同学对装置和试剂上进行了优化):
| 实验学生 | 实验操作 | 现象与结论 |
| 甲 | 滴入浓硝酸前,需先打开弹簧夹,通入一段时间N2,目的是将装置中的空气排出.关闭弹簧夹,打开分液漏斗活塞,加入适量浓硝酸后关闭活塞. | 酸性高锰酸钾溶液不褪色,说明Na2O2能完全吸收NO, |
| 乙 | 去掉装置B,直接将A、C装置相连.打开分液漏斗活塞,加入适量浓硝酸后关闭活塞. | 与甲同学现象相似,说明Na2O2能完全吸收NO2 |
| 丙 | 在乙同学装置的基础上,将A装置中浓硝酸换成浓硫酸,并进行加热,(或将分液漏斗中的试剂换为浓硫酸,将铜换为亚硫酸钠粉末),打开分液漏斗活塞,加入适量试剂后关闭活塞. | 与甲同学现象相似,说明Na2O2能完全吸收NO2 |
| 容器编号 | 起始时各物质的物质的量/mol | 平衡时反应中的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 2 | 3 | 0 | 放出热量b kJ |
| ③ | 2 | 6 | 0 | 放出热量c kJ |
| A. | 反应的平衡常数:③>①>② | |
| B. | 达到平衡时氨气的体积分数:①>③ | |
| C. | 放出的热量(kJ):a<b<92.4 | |
| D. | 反应得到1mol NH3(l),放出热量46.2kJ |
| A. | Al2O3作耐火材料是因为氧化铝熔点高 | |
| B. | “血液透析”利用了胶体的性质 | |
| C. | 糖类、油脂、蛋白质均能发生水解 | |
| D. | 家用燃煤中适量的生石灰能有效减少二氧化硫的排放 |

 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$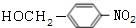 +NaCl.
+NaCl.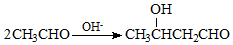 .
.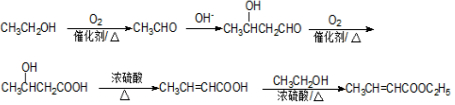 .
.