题目内容
18.工业上电解氧化铝要求其纯度不得低于98.2%,而天然铝土矿的氧化铝含量为50%~70%,杂质主要为SiO2、Fe2O3、CaO、MgO、Na2O等.工业生产铝锭的工艺流程示意图如下: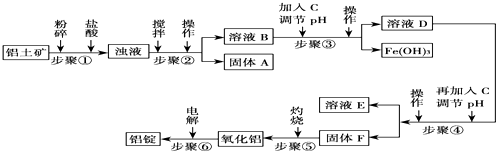
部分氢氧化物沉淀的pH如下表
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH2 |
| 开始沉淀pH (离子初始浓度0.01mol/L) | 4.3 | 2.3 | 10.4 |
| 完全沉淀pH (离子浓度<10-5 mol/L) | 5.2 | 4.1 | 12.4 |
(1)加入盐酸时,氧化铝发生反应的离子方程式为Al2O3+6H+═2Al3++3H2O.
(2)实验室进行步骤②的操作名称为过滤,其使用到的玻璃仪器是漏斗、烧杯、玻璃棒.
(3)固体A的化学式为SiO2,物质C的化学式为NaOH[或Ca(OH)2];溶液中的Na+、Ca2+、Mg2+是在步骤④(填序号)中分离出去的.
(4)步骤③调节pH的数值范围为4.1≤pH<4.3,步骤④调节pH的数值范围为5.2≤pH<10.4.
分析 (1)氧化铝和盐酸反应生成对应的盐和水;
(2)分离液态和不溶性固体采用过滤的方法;其使用到的玻璃仪器是漏斗、烧杯、玻璃棒;
(3)和盐酸不反应的固体是二氧化硅;根据原子守恒判断加入的C物质;在步骤④中利用物质的溶解性除去Na+、Ca2+、Mg2+;
(4)步骤③中调节溶液的pH,使铁离子完全生成氢氧化铁沉淀;步骤④中调节溶液pH,使铝离子沉淀完全而镁离子不产生沉淀.
解答 解:(1)氧化铝和盐酸反应生成氯化铝和水,离子反应方程式为:Al2O3+6H+=2Al3++3H2O,故答案为:Al2O3+6H+=2Al3++3H2O;
(2)分离液态和不溶性固体采用过滤的方法,其使用到的玻璃仪器是漏斗、烧杯、玻璃棒,故答案为:过滤;漏斗、烧杯、玻璃棒;
(3)二氧化硅和盐酸不反应,所以A固体物质是SiO2,步骤③中加入的物质C中和盐酸,且除去铁离子,应该碱,一般常用NaOH 或Ca(OH)2溶液,步骤④中调节溶液pH,使铝离子完全沉淀,而其它离子不沉淀,所以溶液中的Na+、Ca2+、Mg2+是在步骤④中除去的,
故答案为:SiO2;NaOH[或Ca(OH)2];④;
(4)根据表格知,步骤③中要完全除去铁离子,溶液的pH=4.1,pH=4.3时铝离子开始沉淀,pH=5.2时铝离子完全沉淀,所以要完全除去铁离子,溶液的4.1≤pH<4.3;步骤④中要使铝离子完全沉淀,溶液的pH=5.2,镁离子开始沉淀溶液的pH=10.4,所以要使铝离子沉淀完全而镁离子不产生沉淀,则溶液的5.2≤pH<10.4,
故答案为:4.1≤pH<4.3;5.2≤pH<10.4.
点评 本题考查物质的制备,根据物质的性质来分析解答,难点是溶液pH的判断,结合表格中的数据进行分析,难度中等.

练习册系列答案
相关题目
15.用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶于一洁净的锥形瓶中,然后用0.20mol•L-1的氢氧化钠溶液(指示剂为酚酞)作为标准液来滴定.造成测定结果偏高的原因可能是( )
| A. | 用固体氢氧化钠配制标准溶液时其中混有Na2O杂质 | |
| B. | 滴定终点读数时,俯视滴定管的刻度,其它操作均正确 | |
| C. | 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗 | |
| D. | 滴定到终点读数时发现碱式滴定管尖嘴处悬挂一滴溶液 |
9.下列关于NA的说法正确的是( )
| A. | 标准状况下,33.6L氟化氢中含有氟原子数目为1.5NA个 | |
| B. | 1 molNa2O2与足量CO2反应,转移的电子数为2NA个 | |
| C. | 1L,1mol/L CH3COOH溶液中,所含CH3COO-、CH3COOH的总数为NA个 | |
| D. | 6.0g SiO2晶体中含有0.1NA个SiO2分子 |
6.向溶液X中持续通入气体Y,不会产生“浑浊→澄清”现象的是( )
| A. | X:澄清石灰水,Y:二氧化硫 | B. | X:漂白粉溶液,Y:二氧化硫 | ||
| C. | X:氢氧化钡溶液,Y:二氧化碳 | D. | X:偏铝酸钠溶液,Y:二氧化氮 |
13.下列离子方程式正确的是( )
| A. | 氯气和水发生反应:Cl2+H2O?2H++Cl-+ClO- | |
| B. | 金属钠和水反应:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 用氢氧化钠除去铝表面的氧化膜时产生气泡的反应2Al+2OH-+6H2O═2[Al(OH)4]-+3H2↑ | |
| D. | 将金属铁加入稀硫酸和硝酸钾混合溶液中,金属溶解:Fe+2H+═Fe2++H2↑ |
3.利用碳酸钠晶体(Na2CO3•10H2O)来配制0.5mol/L的Na2CO3溶液1000mL,假如其他操作均准确无误,下列情况会引起配制溶液的浓度偏高的是( )
| A. | 称取碳酸钠晶体66g | |
| B. | 定容时,俯视观察刻度线 | |
| C. | 移液时,对用于溶解碳酸钠晶体的烧杯没有进行冲洗 | |
| D. | 定容后,将容量瓶振荡均匀,静置时发现液面低于刻度线,于是又加入少量水至刻度线 |
7.下列由实验现象得出的结论正确的是( )
| 操作及现象 | 结论 | |
| A | 将铜粉加入1.0mol•L-1Fe2(SO4)3溶液中,溶液变蓝 | 金属铁比铜活泼 |
| B | 向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色 | 溶液中一定含有Fe2+ |
| C | 向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色. | Br-还原性强于Cl- |
| D | 加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体凝结. | NH4Cl固体可以升华 |
| A. | A | B. | B | C. | C | D. | D |
8.下列过程中,共价键被破坏的是( )
| A. | 碘升华 | B. | 溴蒸气被木炭吸附 | ||
| C. | 加热使氯化铵分解 | D. | 氯化氢气体溶于水 |