题目内容
6.向溶液X中持续通入气体Y,不会产生“浑浊→澄清”现象的是( )| A. | X:澄清石灰水,Y:二氧化硫 | B. | X:漂白粉溶液,Y:二氧化硫 | ||
| C. | X:氢氧化钡溶液,Y:二氧化碳 | D. | X:偏铝酸钠溶液,Y:二氧化氮 |
分析 A.先生成亚硫酸钙,二氧化碳过量生成亚硫氢钙;
B.发生氧化还原反应生成硫酸钙;
C.先生成碳酸钡,二氧化碳过量生成碳酸氢钡;
D.开始生成氢氧化铝,然后溶解在硝酸中.
解答 解:A.先生成亚硫酸钙,二氧化碳过量生成亚硫酸氢钙,先浑浊后澄清,故A不选;
B.漂白粉溶液中通入二氧化硫,发生氧化还原反应生成硫酸钙,溶液变浑浊,不会变澄清,故B选;
C.先生成碳酸钡,二氧化碳过量生成碳酸氢钡,先浑浊后澄清,故C不选;
D.偏铝酸钠溶液中通入二氧化氮,二氧化氮与水反应生成硝酸,与偏铝酸钠反应生成氢氧化铝,然后溶解在硝酸中生成硝酸铝,则会产生“浑浊→澄清”现象,故D不选.
故选B.
点评 本题考查物质的性质,为高频考点,综合考查元素化合物知识,把握发生的氧化还原反应、复分解反应为解答的关键,注意物质的溶解性及氢氧化铝的两性,题目难度不大.

练习册系列答案
相关题目
3.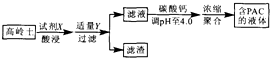 采用高岭土(主要成分为A12 O3、SiO2和Fe2O3)为原料制备水质净化剂PAC{[A12(OH)nC16-n]m(n<6,m为聚合度)}的过程如图.下列说法正确的是( )
采用高岭土(主要成分为A12 O3、SiO2和Fe2O3)为原料制备水质净化剂PAC{[A12(OH)nC16-n]m(n<6,m为聚合度)}的过程如图.下列说法正确的是( )
 采用高岭土(主要成分为A12 O3、SiO2和Fe2O3)为原料制备水质净化剂PAC{[A12(OH)nC16-n]m(n<6,m为聚合度)}的过程如图.下列说法正确的是( )
采用高岭土(主要成分为A12 O3、SiO2和Fe2O3)为原料制备水质净化剂PAC{[A12(OH)nC16-n]m(n<6,m为聚合度)}的过程如图.下列说法正确的是( )| A. | 试剂X为H2SO4 | B. | 滤渣主要成分为Fe(OH)3、H2 SiO3 | ||
| C. | 调pH过高或过低均会减少PAC生成 | D. | 滤液浓缩聚合过程发生了加聚反应 |
17.实验室使用pH传感器来测定Na2CO3和NaHCO3混合物中NaHCO3的含量,称取1.59g样品,溶于水配成250.00mL溶液,取出该溶液25.00mL用0.010mol•L-1盐酸滴定,得到图曲线.下列说法不正确的是( )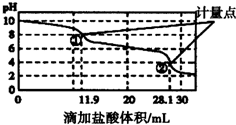

| A. | 此样品n(NaHCO3)=(28.1-11.9)×10-4mol | |
| B. | 计量点②溶液中大量存在的阴离子是Cl- | |
| C. | 计量点①-②之间发生反应的离子方程式为HCO3-+H+═H2O+CO2↑ | |
| D. | 使用该方法测定Na2CO3和NaOH混合溶液中的NaOH含量,将会得到1个计量点 |
11.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 1 mol-OH中含有10 NA个电子 | |
| B. | 1 L 1 mol•L-1CH3COONa溶液中含有NA个CH3COO- | |
| C. | 28g晶体硅中含有共价键数目为2NA个 | |
| D. | 常温常压下11.2 L甲烷气体含有的分子数为0.5NA |
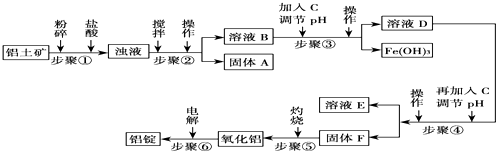
18.工业上电解氧化铝要求其纯度不得低于98.2%,而天然铝土矿的氧化铝含量为50%~70%,杂质主要为SiO2、Fe2O3、CaO、MgO、Na2O等.工业生产铝锭的工艺流程示意图如下:
部分氢氧化物沉淀的pH如下表
请回答下列问题:
(1)加入盐酸时,氧化铝发生反应的离子方程式为Al2O3+6H+═2Al3++3H2O.
(2)实验室进行步骤②的操作名称为过滤,其使用到的玻璃仪器是漏斗、烧杯、玻璃棒.
(3)固体A的化学式为SiO2,物质C的化学式为NaOH[或Ca(OH)2];溶液中的Na+、Ca2+、Mg2+是在步骤④(填序号)中分离出去的.
(4)步骤③调节pH的数值范围为4.1≤pH<4.3,步骤④调节pH的数值范围为5.2≤pH<10.4.

部分氢氧化物沉淀的pH如下表
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH2 |
| 开始沉淀pH (离子初始浓度0.01mol/L) | 4.3 | 2.3 | 10.4 |
| 完全沉淀pH (离子浓度<10-5 mol/L) | 5.2 | 4.1 | 12.4 |
(1)加入盐酸时,氧化铝发生反应的离子方程式为Al2O3+6H+═2Al3++3H2O.
(2)实验室进行步骤②的操作名称为过滤,其使用到的玻璃仪器是漏斗、烧杯、玻璃棒.
(3)固体A的化学式为SiO2,物质C的化学式为NaOH[或Ca(OH)2];溶液中的Na+、Ca2+、Mg2+是在步骤④(填序号)中分离出去的.
(4)步骤③调节pH的数值范围为4.1≤pH<4.3,步骤④调节pH的数值范围为5.2≤pH<10.4.
15.下列物质在所述变化中,既发生离子键破坏,又发生共价键破坏的是( )
| A. | 干冰升华 | B. | 烧碱融化 | C. | HCl气体溶于水 | D. | NH4Cl受热分解 |