题目内容
9.下列关于NA的说法正确的是( )| A. | 标准状况下,33.6L氟化氢中含有氟原子数目为1.5NA个 | |
| B. | 1 molNa2O2与足量CO2反应,转移的电子数为2NA个 | |
| C. | 1L,1mol/L CH3COOH溶液中,所含CH3COO-、CH3COOH的总数为NA个 | |
| D. | 6.0g SiO2晶体中含有0.1NA个SiO2分子 |
分析 A、标况下HF为液态;
B、过氧化钠和二氧化碳的反应为歧化反应;
C、求出醋酸的物质的量,然后根据物料守恒来分析;
D、二氧化硅为原子晶体;
解答 解:A、标况下HF为液态,故不能根据气体摩尔体积来计算其物质的量和含有的F原子个数,故A错误;
B、过氧化钠和二氧化碳的反应为歧化反应,1mol过氧化钠中的1mol-1价的氧原子变为0价,另1mol-1价的氧原子变为-2价,故1mol过氧化钠转移1mol电子即NA个,故B错误;
C、溶液中醋酸的物质的量n=CV=1mol/L×1L=1mol,而醋酸是弱酸,在溶液中部分电离为醋酸根,根据物料守恒可知,溶液中的所含CH3COO-、CH3COOH的总数为NA个,故C正确;
D、二氧化硅为原子晶体,不存在二氧化硅分子,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
6.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1mol•L-1的氯化铁溶液中,若Fe3+的数目为 NA,则Cl-的数目为3NA | |
| B. | 常温下,1 mol Fe与足量稀HNO3反应,转移电子的数目为2 NA | |
| C. | 8.0gCu2S和CuO的混合物中含有的铜原子数为0.1NA | |
| D. | 标准状况下,2.24 LCl2溶于水,转移电子的数目为0.1NA |
7.下列说法正确的是( )
| A. | 等质量的甲醇、甲醛、甲酸完全燃烧时的耗氧量依次递减 | |
| B. | 在淀粉溶液中加入适量稀硫酸微热一段时间,然后加入过量Na0H中和后,滴加几滴碘水,无明显现象,说明淀粉已经完全水解 | |
| C. | 总质量一定时,乙炔和乙醛无论按什么比例混合,完全燃烧消耗氧气量或生成CO2量不变 | |
| D. | 丙烯酸(CH3=CHCOOH)和山梨酸(CH3CH=CHCH=CHCOOH)不是同系物,它们与氢气充分反应后的产物也不是同系物. |
17.实验室使用pH传感器来测定Na2CO3和NaHCO3混合物中NaHCO3的含量,称取1.59g样品,溶于水配成250.00mL溶液,取出该溶液25.00mL用0.010mol•L-1盐酸滴定,得到图曲线.下列说法不正确的是( )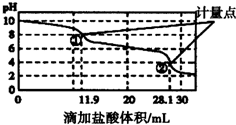

| A. | 此样品n(NaHCO3)=(28.1-11.9)×10-4mol | |
| B. | 计量点②溶液中大量存在的阴离子是Cl- | |
| C. | 计量点①-②之间发生反应的离子方程式为HCO3-+H+═H2O+CO2↑ | |
| D. | 使用该方法测定Na2CO3和NaOH混合溶液中的NaOH含量,将会得到1个计量点 |
4.三氯化磷分子和氨分子结构和空间构型相似,是三角锥形而不是平面正三角形,下列关于三氯化磷分子的叙述,不正确的是( )
| A. | PCl3分子中三个共价键的键长、键能和键角都相等 | |
| B. | PCl3分子中的P-Cl 键属于极性共价键 | |
| C. | PCl3分子中既有σ键,又有π键 | |
| D. | PCl3分子中各原子都达到8电子稳定结构 |
18.工业上电解氧化铝要求其纯度不得低于98.2%,而天然铝土矿的氧化铝含量为50%~70%,杂质主要为SiO2、Fe2O3、CaO、MgO、Na2O等.工业生产铝锭的工艺流程示意图如下:
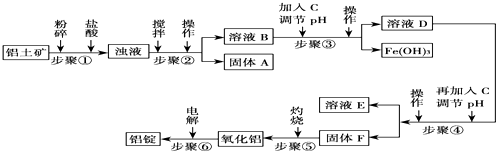
部分氢氧化物沉淀的pH如下表
请回答下列问题:
(1)加入盐酸时,氧化铝发生反应的离子方程式为Al2O3+6H+═2Al3++3H2O.
(2)实验室进行步骤②的操作名称为过滤,其使用到的玻璃仪器是漏斗、烧杯、玻璃棒.
(3)固体A的化学式为SiO2,物质C的化学式为NaOH[或Ca(OH)2];溶液中的Na+、Ca2+、Mg2+是在步骤④(填序号)中分离出去的.
(4)步骤③调节pH的数值范围为4.1≤pH<4.3,步骤④调节pH的数值范围为5.2≤pH<10.4.

部分氢氧化物沉淀的pH如下表
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH2 |
| 开始沉淀pH (离子初始浓度0.01mol/L) | 4.3 | 2.3 | 10.4 |
| 完全沉淀pH (离子浓度<10-5 mol/L) | 5.2 | 4.1 | 12.4 |
(1)加入盐酸时,氧化铝发生反应的离子方程式为Al2O3+6H+═2Al3++3H2O.
(2)实验室进行步骤②的操作名称为过滤,其使用到的玻璃仪器是漏斗、烧杯、玻璃棒.
(3)固体A的化学式为SiO2,物质C的化学式为NaOH[或Ca(OH)2];溶液中的Na+、Ca2+、Mg2+是在步骤④(填序号)中分离出去的.
(4)步骤③调节pH的数值范围为4.1≤pH<4.3,步骤④调节pH的数值范围为5.2≤pH<10.4.
19.对于放热反应H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl,下列说法中,正确的是( )
| A. | 生成物所具有的总能量高于反应物所具有的总能量 | |
| B. | 反应物所具有的总能量高于生成物所具有的总能量 | |
| C. | 断开1 mol H-H键和1 mol Cl-Cl键所吸收的总能量大于形成2mol H-Cl键所放出的能量 | |
| D. | 该反应中,化学能只转变为热能 |