题目内容
 “问题胶囊”事件引发了各方关注和热议,国际食品包装协会秘书长董金狮教授说:“工业明胶中重金属铬的毒性远高于三聚氰胺”.铬是严重的致癌物质,绝不允许含铬废水随意排放.请回答下列问题:
“问题胶囊”事件引发了各方关注和热议,国际食品包装协会秘书长董金狮教授说:“工业明胶中重金属铬的毒性远高于三聚氰胺”.铬是严重的致癌物质,绝不允许含铬废水随意排放.请回答下列问题:(1)三聚氰胺中N原子的杂化方式是
(2)酸性溶液中过氧化氢能使Cr2072-生成蓝色的过氧化铬(CrO5,分子结构为
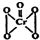 ,该反应可用来检验Cr2072-的存在.过氧化铬中铬元素的化合价为
,该反应可用来检验Cr2072-的存在.过氧化铬中铬元素的化合价为(3)一种治理含Cr2072-酸性工业废水的方法是向废水中加入适量的食盐,用铁作电极进行电解,Cr2072-被还原为Cr3+,然后生成Cr(OH)3沉淀除去,以达到排放标准.
①加适量食盐的目的是
②已知电解后溶液中c(Fe3+)为4.0×10-13mol?L-1,则溶液中c(Cr3+)浓度为
(已知KsP[Fe(OH)3]=4.0×10-38; Ksp[Cr(OH)3]=6.0×10-31)
考点:原子轨道杂化方式及杂化类型判断,离子方程式的书写,电解原理
专题:化学键与晶体结构,电化学专题
分析:(1)三聚氰胺分子中,氨基上的N原子成3个σ 键、有一个孤电子对,环上的N原子成2个σ 键、有一个孤电子对,杂化轨道数=σ 键数+孤电子对数,据此确定N原子杂化方式;
(2)根据过氧化铬的结构简式可知存在过氧键、Cr-O键、Cr=O来分析;过氧化氢与K2Cr2O7在酸性溶液中发生反应生成CrO5和水;
(3)①加入适量的NaCl可增强溶液的导电能力,Cr2O72-具有强氧化性,可以将亚铁离子氧化为铁离子,自身被还原为Cr3+,铁离子与氢氧根离子结合生成Fe(OH)3沉淀;
②先根据KspFe(OH)3和c(Fe3+)求出c(OH-),然后再根据c(OH-)和KspCr(OH)3求出c(Cr3+);
(2)根据过氧化铬的结构简式可知存在过氧键、Cr-O键、Cr=O来分析;过氧化氢与K2Cr2O7在酸性溶液中发生反应生成CrO5和水;
(3)①加入适量的NaCl可增强溶液的导电能力,Cr2O72-具有强氧化性,可以将亚铁离子氧化为铁离子,自身被还原为Cr3+,铁离子与氢氧根离子结合生成Fe(OH)3沉淀;
②先根据KspFe(OH)3和c(Fe3+)求出c(OH-),然后再根据c(OH-)和KspCr(OH)3求出c(Cr3+);
解答:
解:(1)三聚氰胺分子中,氨基上的N原子含有3个 σ 键和一个孤电子对,所以采取sp3杂化,环上的N原子含有2个 σ 键和一个孤电子对,所以采取sp2杂化,
故答案为:sp2、sp3;
(2)根据过氧化铬的结构简式可知一个铬与五个氧形成形成六个铬氧极性共价键,共用电子对偏向都偏向氧,所以呈+6,结构式中存在过氧键、Cr-O键、Cr=O,在4个Cr-O键中O为-1价,在Cr=O键注重O为-2价;
过氧化氢与K2Cr2O7在酸性溶液中发生反应生成CrO5和水,离子反应为4H2O2+Cr2O72-+2H+═2CrO5+5H2O;
故答案为:+6;4H2O2+Cr2O72-+2H+═2CrO5+5H2O;
(3)①因NaCl为电解质,加入适量的NaCl可增强溶液的导电能力,亚铁离子与Cr2O72-发生氧化还原反应Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,亚铁离子被氧化为铁离子,与氢氧根离子结合生成Fe(OH)3沉淀,
故答案为:增大离子浓度,增强导电能力;Fe(OH)3;
②Fe(OH)3(s)?Fe3+(aq)+3OH-(aq),溶液中c(OH-)=
=
mol/L=
mol/L,
则溶液中c(Cr3+)=
=
=6.0×10ˉ6mol/L,
故答案为:6.0×10-6 mol?L-1;
故答案为:sp2、sp3;
(2)根据过氧化铬的结构简式可知一个铬与五个氧形成形成六个铬氧极性共价键,共用电子对偏向都偏向氧,所以呈+6,结构式中存在过氧键、Cr-O键、Cr=O,在4个Cr-O键中O为-1价,在Cr=O键注重O为-2价;
过氧化氢与K2Cr2O7在酸性溶液中发生反应生成CrO5和水,离子反应为4H2O2+Cr2O72-+2H+═2CrO5+5H2O;
故答案为:+6;4H2O2+Cr2O72-+2H+═2CrO5+5H2O;
(3)①因NaCl为电解质,加入适量的NaCl可增强溶液的导电能力,亚铁离子与Cr2O72-发生氧化还原反应Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,亚铁离子被氧化为铁离子,与氢氧根离子结合生成Fe(OH)3沉淀,
故答案为:增大离子浓度,增强导电能力;Fe(OH)3;
②Fe(OH)3(s)?Fe3+(aq)+3OH-(aq),溶液中c(OH-)=
| 3 |
| ||
| 3 |
| ||
| 3 | 1×10-25 |
则溶液中c(Cr3+)=
| KSPCr(OH)3 |
| C3(OH-) |
| 6.0×10-31 |
| 1×10-25 |
故答案为:6.0×10-6 mol?L-1;
点评:本题考查较为综合,题目难度较大,涉及原子杂化、氧化还原反应、沉淀溶解平衡的计算等知识点,根据过氧化铬的结构简式判断铬的化合价、沉淀溶解平衡的计算是解答难点,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
已知镁粉与冷水几乎不反应,与热水反应缓慢.市场上购买的“即热饭盒”底部有两层,一层装水,另一层是镁粉与铁粉的混合物,当水与金属粉末接触时会发生反应:Mg+2H2O=Mg(OH)2+H2↑.则下列说法不正确的是( )
| A、“即热饭盒”的工作原理是将化学能转化为热能 |
| B、上述反应中,反应物的总能量大于生成物的总能量 |
| C、铁粉的作用是催化剂 |
| D、上述反应的反应热△H>0 |
在K37ClO3+6HCl═KCl+3Cl2↑+3H2O反应中( )
| A、氧化产物与还原产物物质的量比是3:1 | ||
B、被氧化的HCl占参加反应HCl总量的
| ||
| C、K37ClO3只有一部分发生还原反应 | ||
| D、反应完成后37Cl存在于KCl |
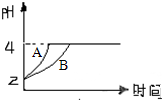 (1)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色.则该溶液呈
(1)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色.则该溶液呈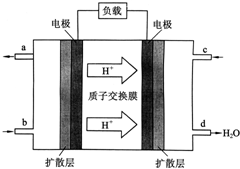 中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图所示.
中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图所示.