题目内容
A、B、C、D为四种中学化学中常见的单质.常温时A为淡黄色固体,B也是固体且B可被磁化;C和D是双原子分子的气体,C呈黄绿色.E、F、G、H、I为五种化合物,E难溶于水,F为气体,且极易溶于水得无色酸性溶液;H溶于水后得黄色或棕黄色溶液.它们之间有如下反应的转化关系:
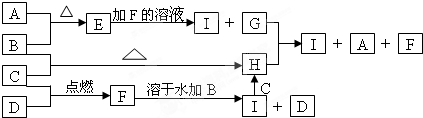
(1)四种物质的化学式:B ,C ,H ,G ;
(2)用实验方法鉴别H和I可用 试剂,现象是 ;
(3)写出G+H→I+A+F的离子方程式 .

(1)四种物质的化学式:B
(2)用实验方法鉴别H和I可用
(3)写出G+H→I+A+F的离子方程式
考点:无机物的推断
专题:推断题
分析:常温时A为淡黄色固体单质,应为S,单质B也是固体且B可被磁化,则A应为Fe,则E为FeS,C和D是双原子分子的气体,C呈黄绿色,应为Cl2,B与C反应生成H,则H为FeCl3,FeCl3溶于水后得黄色或棕黄色溶液,C、D在点燃条件下反应生成气体F,且F极易溶于水,可推知D为H2,F为HCl,则I为FeCl2,G为H2S,硫化氢与氯化铁反应得到S、氯化亚铁、HCl,Fe与盐酸反应得到氯化亚铁与氢气,氯化亚铁与氯气反应得到氯化铁,验证符合转化关系,据此解答.
解答:
解:常温时A为淡黄色固体单质,应为S,单质B也是固体且B可被磁化,则A应为Fe,则E为FeS,C和D是双原子分子的气体,C呈黄绿色,应为Cl2,B与C反应生成H,则H为FeCl3,FeCl3溶于水后得黄色或棕黄色溶液,C、D在点燃条件下反应生成气体F,且F极易溶于水,可推知D为H2,F为HCl,则I为FeCl2,G为H2S,硫化氢与氯化铁反应得到S、氯化亚铁、HCl,Fe与盐酸反应得到氯化亚铁与氢气,氯化亚铁与氯气反应得到氯化铁,验证符合转化关系,
(1)由以上分析可知,B为Fe,C为Cl2,H为FeCl3,G为H2S,
故答案为:Fe;Cl2;FeCl3;H2S;
(2)I为FeCl2,H为FeCl3,可用KSCN溶液鉴别,溶液呈血红色的为FeCl3,
故答案为:KSCN;溶液显血红色;
(3)G+H→I+A+F反应是Fe3+与H2S发生氧化还原反应,反应的离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+,
故答案为:2Fe3++H2S=2Fe2++S↓+2H+.
(1)由以上分析可知,B为Fe,C为Cl2,H为FeCl3,G为H2S,
故答案为:Fe;Cl2;FeCl3;H2S;
(2)I为FeCl2,H为FeCl3,可用KSCN溶液鉴别,溶液呈血红色的为FeCl3,
故答案为:KSCN;溶液显血红色;
(3)G+H→I+A+F反应是Fe3+与H2S发生氧化还原反应,反应的离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+,
故答案为:2Fe3++H2S=2Fe2++S↓+2H+.
点评:本题考查无机物推断,涉及Fe、Cl元素化合物性质,物质的颜色及性质是推断突破口,再结合转化关系推断,需要学生熟练掌握元素化合物知识,难度中等.

练习册系列答案
相关题目
已知4NH3(g)+5O2(g)═4NO(g)+6H2O(l)△H═-xkJ/mol.蒸发1mol H2O(l)需要吸收的能量为44kJ,其它相关数据如下表:则表中z(用x、a、b、d表示)的大小为( )
| 物质 | NH3(g) | O2(g) | NO(g) | H2O(g) |
| 1mol分子中的化学键断裂时需要吸收的能量/kJ | a | b | z | d |
A、
| ||
B、
| ||
C、
| ||
D、
|
 I、向AlCl3溶液中滴加NaOH溶液至过量
I、向AlCl3溶液中滴加NaOH溶液至过量 溴被称为“海洋元素”.已知Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性.实验室模拟从海水中提取溴的主要步骤为:
溴被称为“海洋元素”.已知Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性.实验室模拟从海水中提取溴的主要步骤为: “问题胶囊”事件引发了各方关注和热议,国际食品包装协会秘书长董金狮教授说:“工业明胶中重金属铬的毒性远高于三聚氰胺”.铬是严重的致癌物质,绝不允许含铬废水随意排放.请回答下列问题:
“问题胶囊”事件引发了各方关注和热议,国际食品包装协会秘书长董金狮教授说:“工业明胶中重金属铬的毒性远高于三聚氰胺”.铬是严重的致癌物质,绝不允许含铬废水随意排放.请回答下列问题: ,该反应可用来检验Cr2072-的存在.过氧化铬中铬元素的化合价为
,该反应可用来检验Cr2072-的存在.过氧化铬中铬元素的化合价为