题目内容
在K37ClO3+6HCl═KCl+3Cl2↑+3H2O反应中( )
| A、氧化产物与还原产物物质的量比是3:1 | ||
B、被氧化的HCl占参加反应HCl总量的
| ||
| C、K37ClO3只有一部分发生还原反应 | ||
| D、反应完成后37Cl存在于KCl |
考点:氧化还原反应
专题:氧化还原反应专题
分析:K37ClO3+6HCl═KCl+3Cl2↑+3H2O中,37Cl元素的化合价由+5价降低为0,Cl元素的化合价由-1价升高为0,6molHCl反应只有5mol作还原剂,以此来解答.
解答:
解:A.只有Cl元素的化合价变化,氧化产物和还原产物均为氯气,1个Cl得电子与5个Cl失去电子遵循电子守恒,则氧化产物与还原产物物质的量比是5:1,故A错误;
B.6molHCl反应只有5mol作还原剂,则被氧化的HCl占参加反应HCl总量的
,故B正确;
C.K37ClO3中Cl全部发生还原反应,故C错误;
D.反应完成后37Cl存在于中Cl2,故D错误;
故选B.
B.6molHCl反应只有5mol作还原剂,则被氧化的HCl占参加反应HCl总量的
| 5 |
| 6 |
C.K37ClO3中Cl全部发生还原反应,故C错误;
D.反应完成后37Cl存在于中Cl2,故D错误;
故选B.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,注意37Cl元素的化合价由+5价降低为0,题目难度不大.

练习册系列答案
相关题目
某实验室需要用480mL 1mol/L的氢氧化钠溶液,有关配制该溶液的叙述正确的是( )
| A、应准确称取NaOH固体19.2g |
| B、定容时仰视读数,所配制的溶液的浓度会偏低 |
| C、为了减少损失,将氢氧化钠固体直接倒入容量瓶,加水溶解 |
| D、摇匀后溶液液面低于刻度线,应补充适量蒸馏水至刻度线 |
用水将pH=3的CH3COOH稀释一倍后,溶液的pH为( )
| A、3 | B、3.15 |
| C、3.3 | D、2.7 |
能正确表示下列反应的离子方程式是( )
| A、向0.1mol/L的Na2S溶液中加入Agl(s)+S2-?Ag2S(s)+2I- | ||
| B、碳酸钠溶液显碱性的原因:CO32-+2H2O?H2CO3+2OH- | ||
C、一氧化硫通入氯化铁溶液:SO2+Fe3++2H2O═SO
| ||
| D、用醋酸清洗盛放石灰水试剂瓶内壁出现的白色固体:CaCO3+2H+═Ca2++H2O+CO2↑ |
 如图是向100毫升的盐酸中,逐渐加入NaOH溶液时,溶液的pH值变化的图象,根据图象所得结论正确的是( )
如图是向100毫升的盐酸中,逐渐加入NaOH溶液时,溶液的pH值变化的图象,根据图象所得结论正确的是( )| A、原来盐酸的物质的量浓度为0.1 mol/L |
| B、X为含0.1 mol的NaOH溶液 |
| C、X为加入了100毫升的NaOH溶液 |
| D、NaOH溶液浓度为0.1 mol/L |
n、l、m确定后,仍不能确定该量子数组合所描述的原子轨道的( )
| A、数目 | B、形状 |
| C、能量 | D、所填充的电子数目 |
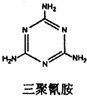 “问题胶囊”事件引发了各方关注和热议,国际食品包装协会秘书长董金狮教授说:“工业明胶中重金属铬的毒性远高于三聚氰胺”.铬是严重的致癌物质,绝不允许含铬废水随意排放.请回答下列问题:
“问题胶囊”事件引发了各方关注和热议,国际食品包装协会秘书长董金狮教授说:“工业明胶中重金属铬的毒性远高于三聚氰胺”.铬是严重的致癌物质,绝不允许含铬废水随意排放.请回答下列问题: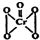 ,该反应可用来检验Cr2072-的存在.过氧化铬中铬元素的化合价为
,该反应可用来检验Cr2072-的存在.过氧化铬中铬元素的化合价为