题目内容
(1)将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)…
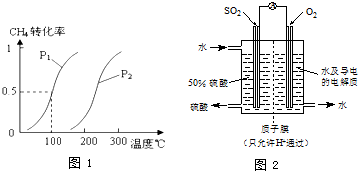
CH4的转化率与温度、压强的关系如图1.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为 .
②图1中的p1 p2(填“<”、“>”或“=”),100℃时平衡常数为 .
③该反应的△H 0(填“<”、“>”或“=”).
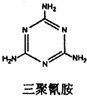
(2)某科研单位利用电化学原理用SO2来制备硫酸,装置如图2,含有某种催化剂,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触.通入SO2的电极为 极,其电极反应式为 ;
(3)己知:Ksp(AgCl)=1.8×10-10,向50mL 0.018mol/L的AgNO3溶液中加入相同体积0.020mol/L的盐酸,则c(Ag+)= .此时所得混合溶液的pH= .
CH4的转化率与温度、压强的关系如图1.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为
②图1中的p1
③该反应的△H
(2)某科研单位利用电化学原理用SO2来制备硫酸,装置如图2,含有某种催化剂,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触.通入SO2的电极为
(3)己知:Ksp(AgCl)=1.8×10-10,向50mL 0.018mol/L的AgNO3溶液中加入相同体积0.020mol/L的盐酸,则c(Ag+)=

考点:产物的百分含量随浓度、时间的变化曲线,原电池和电解池的工作原理,难溶电解质的溶解平衡及沉淀转化的本质
专题:基本概念与基本理论
分析:(1)①根据图象判断100℃时甲烷的转化率,根据反应方程式及甲烷的物质的量计算出生成氢气的物质的量,再根据反应速率的表达式计算出用H2表示该反应的平均反应速率;
②转化率与温度、压强图象有三个变量,采用“定一议二”方法判断压强大小;计算平衡状态时各物质的浓度,代入平衡常数表达式计算;
③根据图象中压强不变,温度升高后甲烷的转化率判断该反应的焓变;
(2)本质为SO2与O2反应生成SO3,SO3再与水化合生成硫酸,负极发生氧化反应,正极发生还原反应,据此进行解答;
(3)依据题干数据计算沉淀后溶液中氯离子浓度,结合Ksp计算溶液中银离子浓度,沉淀后溶液中剩余氢离子浓度,计算溶液pH.
②转化率与温度、压强图象有三个变量,采用“定一议二”方法判断压强大小;计算平衡状态时各物质的浓度,代入平衡常数表达式计算;
③根据图象中压强不变,温度升高后甲烷的转化率判断该反应的焓变;
(2)本质为SO2与O2反应生成SO3,SO3再与水化合生成硫酸,负极发生氧化反应,正极发生还原反应,据此进行解答;
(3)依据题干数据计算沉淀后溶液中氯离子浓度,结合Ksp计算溶液中银离子浓度,沉淀后溶液中剩余氢离子浓度,计算溶液pH.
解答:
解:(1)将1.0mol CH4和2.0mol H2O ( g )通入容积固定为10L的反应室,在一定条件下发生反应I,由图象可知100℃甲烷转化率为50%,故参加反应的甲烷为1mol×50%=0.5mol,则:
CH4 (g)+H2O (g)=CO (g)+3H2 (g)
起始量(mol):1.0 2.0 0 0
变化量(mol):0.5 0.5 0.5 1.5
平衡量(mol):0.5 1.5 0.5 1.5
①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率=
=0.003 mol?L-1?min-1,
故答案为:0.0030mol?L-1?min-1 ;
②通过图表可知当温度相同时,p2→p1时,甲烷的转化率提高,平衡向正向移动,正向为气体系数增大的反应,根据减小压强平衡向系数增大的方向移动可知:p1<p2;
100℃时反应I的平衡浓度为c(CH4)=0.005mol/L,c(H2O)=0.015mol/L,c(CO)=0.005mol/L,c(H2)=0.015mol/L,
平衡常数为:K=
=2.25×10-4,
故答案为:<;2.25×10-4;
③当压强为p1时,升高温度,甲烷的转化率提高,平衡向正向移动,说明正反应为吸热反应,△H>0,
故答案为:>;
(2)该原电池的本质是:2SO2+O2+2H2O=2H2SO4,SO2在负极上发生氧化反应电极反应式为:SO2-2e-+2H2O═SO42-+4H+,O2在正极上发生还原反应电极反应式为:O2+4e-+4H+═2H2O;
故答案为:负; SO2-2e-+2H2O=4H++SO42-;
(3)50 ml 0.02mol/L的盐酸中加入50ml 0.018mol/L AgNO3溶液加入后两者浓度分别为
c(Ag+)=
=0.009 (mol/L)
c(Cl-)=
=0.01(mol/L)
Ag+与Cl-是等物质的量反应的,此时Cl-过量,过量浓度c(Cl-)=0.01-0.009=0.001mol/L;
Ksp=c(Ag+)×C(Cl-)=1.8×10-10,
则:c(Ag+)=
=1.8×10-7(mol/L);
溶液中剩余氢离子浓度=0.01mol/L,
溶液pH=2,
故答案为:1.8×10-7mol/L;2.
CH4 (g)+H2O (g)=CO (g)+3H2 (g)
起始量(mol):1.0 2.0 0 0
变化量(mol):0.5 0.5 0.5 1.5
平衡量(mol):0.5 1.5 0.5 1.5
①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率=
| ||
| 5min |
故答案为:0.0030mol?L-1?min-1 ;
②通过图表可知当温度相同时,p2→p1时,甲烷的转化率提高,平衡向正向移动,正向为气体系数增大的反应,根据减小压强平衡向系数增大的方向移动可知:p1<p2;
100℃时反应I的平衡浓度为c(CH4)=0.005mol/L,c(H2O)=0.015mol/L,c(CO)=0.005mol/L,c(H2)=0.015mol/L,
平衡常数为:K=
| 0.005×0.0153 |
| 0.005×0.015 |
故答案为:<;2.25×10-4;
③当压强为p1时,升高温度,甲烷的转化率提高,平衡向正向移动,说明正反应为吸热反应,△H>0,
故答案为:>;
(2)该原电池的本质是:2SO2+O2+2H2O=2H2SO4,SO2在负极上发生氧化反应电极反应式为:SO2-2e-+2H2O═SO42-+4H+,O2在正极上发生还原反应电极反应式为:O2+4e-+4H+═2H2O;
故答案为:负; SO2-2e-+2H2O=4H++SO42-;
(3)50 ml 0.02mol/L的盐酸中加入50ml 0.018mol/L AgNO3溶液加入后两者浓度分别为
c(Ag+)=
| 0.018 |
| 2 |
c(Cl-)=
| 0.02 |
| 2 |
Ag+与Cl-是等物质的量反应的,此时Cl-过量,过量浓度c(Cl-)=0.01-0.009=0.001mol/L;
Ksp=c(Ag+)×C(Cl-)=1.8×10-10,
则:c(Ag+)=
| 1.8×10-10 |
| 0.001 |
溶液中剩余氢离子浓度=0.01mol/L,
溶液pH=2,
故答案为:1.8×10-7mol/L;2.
点评:本题考查了化学反应速率的计算、化学平衡及其影响、原电池工作原理、难溶物溶解平均及其计算,题目难度中等,试题题量较大,涉及的知识点较多,充分考查了学生对所学知识的掌握情况,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
相关题目
化学与人类生活、社会可持续发展密切相关,下列措施有利于节能减排、保护环境的是( )
①加大开发太阳能、水能、风能、地热能等能源力度,减少化石燃料的使用
②使用纤维素和淀粉制成的可降解塑料,减少“白色污染”
③在田间焚烧秸秆,增加草木灰肥料
④采用催化光解设施,将汽车尾气中CO和NOx转化为无害气体.
①加大开发太阳能、水能、风能、地热能等能源力度,减少化石燃料的使用
②使用纤维素和淀粉制成的可降解塑料,减少“白色污染”
③在田间焚烧秸秆,增加草木灰肥料
④采用催化光解设施,将汽车尾气中CO和NOx转化为无害气体.
| A、①②③ | B、②③④ |
| C、①②④ | D、①③④ |
某实验室需要用480mL 1mol/L的氢氧化钠溶液,有关配制该溶液的叙述正确的是( )
| A、应准确称取NaOH固体19.2g |
| B、定容时仰视读数,所配制的溶液的浓度会偏低 |
| C、为了减少损失,将氢氧化钠固体直接倒入容量瓶,加水溶解 |
| D、摇匀后溶液液面低于刻度线,应补充适量蒸馏水至刻度线 |
 “问题胶囊”事件引发了各方关注和热议,国际食品包装协会秘书长董金狮教授说:“工业明胶中重金属铬的毒性远高于三聚氰胺”.铬是严重的致癌物质,绝不允许含铬废水随意排放.请回答下列问题:
“问题胶囊”事件引发了各方关注和热议,国际食品包装协会秘书长董金狮教授说:“工业明胶中重金属铬的毒性远高于三聚氰胺”.铬是严重的致癌物质,绝不允许含铬废水随意排放.请回答下列问题: ,该反应可用来检验Cr2072-的存在.过氧化铬中铬元素的化合价为
,该反应可用来检验Cr2072-的存在.过氧化铬中铬元素的化合价为 在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按如图1连接.
在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按如图1连接.