题目内容
8.设NA代表阿佛加德罗常数的值,下列说法正确的是( )| A. | 1molNH4Cl固体中共价键总数为5NA | |
| B. | 16gO2与O3的混合物中含有NA个氧原子 | |
| C. | 向装有催化剂的密闭容器加入3molH2和1molN2,充分反应后得2NA个氨分子 | |
| D. | 18g水(H2O)含有8NA个电子 |
分析 A、氯化铵中含4条共价键;
B、氧气和臭氧均由氧原子构成;
C、合成氨的反应为可逆反应;
D、求出水的物质的量,然后根据水为10电子微粒来分析.
解答 解:A、氯化铵含4条共价键,故1mol氯化铵中含4NA条共价键,故A错误;
B、氧气和臭氧均由氧原子构成,故16g混合物中含有的氧原子的物质的量为1mol,则含NA个,故B正确;
C、合成氨的反应为可逆反应,故不能进行彻底,则反应后得到的氨气分子小于2NA个,故C错误;
D、18g水的物质的量为1mol,而水为10电子微粒,故1mol水中含10NA个电子,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
18.某有机物CxHmOn完全燃烧时需要氧气的物质的量是该有机物的x倍,则其化学式中x、m、n的关系不可能是( )
| A. | m:n=2:1 | B. | m=2x | C. | x:m:n=1:2:1 | D. | m=2x+2 |
19.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 能使甲基橙变红的溶液:Mg2+、Na+、NO3-、Cl- | |
| B. | 0.1mol•L-1NH4Cl溶液:K+、Ba2+、OH-、CO32- | |
| C. | 0.1mol•L-1Fe(NO3)2溶液:H+、Al3+、SO42-、I- | |
| D. | 由水电离产生的c(H+)=10-12mol•L-1的溶液:NH4+、SO42-、HCO3-、Cl- |
16.下列递变情况不正确的是( )
| A. | Na、Mg、Al原子最外层电子数依次增多,其简单离子的氧化性依次增强 | |
| B. | P、S、Cl最高正化合价依次升高,对应的气态氢化物的稳定性依次增强 | |
| C. | C、N、O原子半径依次增大 | |
| D. | Na、K、Rb氧化物的水化物碱性依次增强 |
13.在气体反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是( )
①移去生成物②升高温度③增大压强④增大反应物的浓度⑤加入催化剂.
①移去生成物②升高温度③增大压强④增大反应物的浓度⑤加入催化剂.
| A. | ①②③④⑤ | B. | ②③④⑤ | C. | ②⑤ | D. | ③④ |
20.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1mol Mg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为NA | |
| B. | 11g分子式为C3H8的链烃中含有的C-H的数目为2NA | |
| C. | 室温时,1.0L pH=13的 Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| D. | Fe与水蒸气反应生成22.4L氢气,转移的电子数为2NA |
17.下列说法中正确的是( )

| A. | 6.8 g固体KHSO4与3.9 g固体Na2O2中阴离子数目相同 | |
| B. | 常温下铁、铜均不溶于浓硫酸,说明常温下铁、铜与浓硫酸均不反应 | |
| C. | 离子化合物中只含离子键 | |
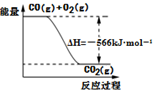
| D. | 已知:2CO(g)+O2(g)═2CO2(g);△H=-566 kJ•mol-1,如图可表示由CO生成CO2的反应过程和能量关系 |
16. Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验:
(1)请完成以下实验设计表( 表中不要留空格)
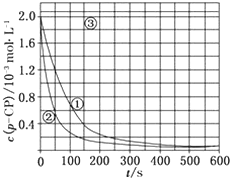
[数据处理]实验测得p-CP的浓度随时间变化的关系如图
(2)请根据上图实验①曲线,计算降解反应50~150s内的反应速率:v(p-CP)=8.0×10-6mol•L-1•s-1;
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大.但后续研究表明:温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:过氧化氢在温度过高时迅速分解;
(4)实验③得出的结论是:pH等于10时,反应不能(填“能”或“不能”)进行;
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法:在溶液中加入碱溶液,使溶液的pH大于或等于10(其他合理答案均可).
 Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验:
(1)请完成以下实验设计表( 表中不要留空格)
| 实验编号 | 实验目的 | T/K | pH | c/10-3 mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 3 | |||
| ③ | 298 | 10 | 6.0 | 0.30 | |
(2)请根据上图实验①曲线,计算降解反应50~150s内的反应速率:v(p-CP)=8.0×10-6mol•L-1•s-1;
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大.但后续研究表明:温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:过氧化氢在温度过高时迅速分解;
(4)实验③得出的结论是:pH等于10时,反应不能(填“能”或“不能”)进行;
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法:在溶液中加入碱溶液,使溶液的pH大于或等于10(其他合理答案均可).
 工业含铬废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀,利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源、以废治废,还能节约生产成本.
工业含铬废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀,利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源、以废治废,还能节约生产成本.