题目内容
4.下列有关说法正确的是( )| A. | 1mol过氧化钠和足量水充分反应,理论上转移的电子数约为2×6.02×1023 | |
| B. | 电工操作中将铝线与铜线直接相连,会导致铜线更快被氧化 | |
| C. | MnS悬浊液中滴加少量CuSO4溶液可生成CuS沉淀,则Ksp(CuS)<Ksp(MnS) | |
| D. | 0.1mol•L-1醋酸溶液pH=a,0.01mol•L-1醋酸溶液pH=b,则a+1<b |
分析 A.Na2O2与足量水反应转移电子数依据化学方程式计算得到,1molNa2O2与足量水反应转移电子1mol;
B.Cu、Al形成原电池时,Al作负极被腐蚀;
C.化学式形式相同的,溶度积越大,溶解度越大;
D.加水稀释促进醋酸电离.
解答 解:A.Na2O2与足量水反应的化学方程式为:2Na2O2+2H2O═4NaOH+O2↑,则1molNa2O2与足量水反应转移电子1mol,即转移的电子数约为6.02×1023,故A错误;
B.Cu、Al形成原电池时,Al作负极被腐蚀,Cu作正极被保护,所以铜不易被氧化,故B错误;
C.化学式形式相同的,溶度积越大,溶解度越大,MnS悬浊液中滴加少量CuSO4溶液可生成CuS沉淀,则Ksp(CuS)<Ksp(MnS),故C正确;
D.0.1mol•L-1醋酸溶液,加水稀释促进醋酸电离,所以0.01mol•L-1醋酸溶液中氢离子浓度大于0.1mol•L-1醋酸溶液中氢离子浓度的$\frac{1}{10}$,则a+1>b,故D错误.
故选C.
点评 本题考查了氧化还原反应、原电池原理的应用、溶度积常数、弱电解质的电离等,题目涉及的知识点较多,侧重于考查学生对基础知识的应用能力,题目难度中等.

练习册系列答案
相关题目
14.下列物质不属于有机物的是( )
| A. | C2H4 | B. | C12H22O11 | C. | C60 | D. | HCOOH |
15.重水(2H2O)是重要的核工业原料,下列说法不正确的是( )
| A. | 氘(2H)原子核内有1个质子 | |
| B. | 1H与2H是不同的核素 | |
| C. | 1H218O与2H216O的相对分子质量相同 | |
| D. | 1H2O与2H2O互为同位素 |
12.汽车尾气中含有CO、NO等有害气体.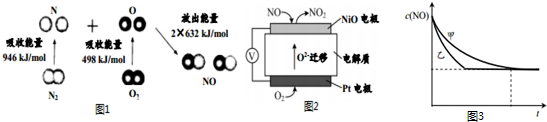
(1)汽车尾气中NO生成过程的能量变化示意图如图1.该条件下,1molN2和1molO2完全反应生成NO,会吸收(填“吸收”或“放出”)180kJ能量.
(2)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图2所示:
①NiO电极上发生的是氧化反应(填“氧化”或“还原”).
②外电路中,电子流动方向是从NiO电极流向pt电极(填“NiO”或“pt”).
③pt电极上的电极反应式为O2+4e-=2O2-.
(2)一种新型催化剂能使NO和CO发生反应:2NO+2CO?2CO2+N2.已知增大催化剂的比表面积可提高该反应速率.为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中.
①请表中数据补充完整:a1.2×10-3;b5.80×10-3.
②能验证温度对化学反应速率规律的是实验Ⅰ和Ⅲ(填实验序号).
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图3所示,其中表示实验Ⅱ的是曲线乙(填“甲”或“乙”).

(1)汽车尾气中NO生成过程的能量变化示意图如图1.该条件下,1molN2和1molO2完全反应生成NO,会吸收(填“吸收”或“放出”)180kJ能量.
(2)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图2所示:
①NiO电极上发生的是氧化反应(填“氧化”或“还原”).
②外电路中,电子流动方向是从NiO电极流向pt电极(填“NiO”或“pt”).
③pt电极上的电极反应式为O2+4e-=2O2-.
(2)一种新型催化剂能使NO和CO发生反应:2NO+2CO?2CO2+N2.已知增大催化剂的比表面积可提高该反应速率.为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中.
| 实验编号 | t (℃) | NO初始浓度 | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.2×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | 1.2×10-3 | b | 124 |
| Ⅲ | 350 | a | 5.8×10-3 | 82 |
②能验证温度对化学反应速率规律的是实验Ⅰ和Ⅲ(填实验序号).
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图3所示,其中表示实验Ⅱ的是曲线乙(填“甲”或“乙”).
19.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 能使甲基橙变红的溶液:Mg2+、Na+、NO3-、Cl- | |
| B. | 0.1mol•L-1NH4Cl溶液:K+、Ba2+、OH-、CO32- | |
| C. | 0.1mol•L-1Fe(NO3)2溶液:H+、Al3+、SO42-、I- | |
| D. | 由水电离产生的c(H+)=10-12mol•L-1的溶液:NH4+、SO42-、HCO3-、Cl- |
16.下列递变情况不正确的是( )
| A. | Na、Mg、Al原子最外层电子数依次增多,其简单离子的氧化性依次增强 | |
| B. | P、S、Cl最高正化合价依次升高,对应的气态氢化物的稳定性依次增强 | |
| C. | C、N、O原子半径依次增大 | |
| D. | Na、K、Rb氧化物的水化物碱性依次增强 |
13.在气体反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是( )
①移去生成物②升高温度③增大压强④增大反应物的浓度⑤加入催化剂.
①移去生成物②升高温度③增大压强④增大反应物的浓度⑤加入催化剂.
| A. | ①②③④⑤ | B. | ②③④⑤ | C. | ②⑤ | D. | ③④ |
14.下列有关实验的操作正确的是( )
| A. | 检验某补铁药片(主要成分为亚铁化合物)是否氧化变质,使用氯水和硫氰化钾溶液 | |
| B. | 测定溶液pH时,可用pH试纸蘸取少量待测液,并与标准比色卡比较 | |
| C. | 容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度,使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| D. | 测定碳酸钠中碳酸氢钠的含量:取a克样品与足量稀盐酸充分反应,逸出的气体通过碱石灰后,碱石灰增重b克,根据a和b的值即可求得碳酸氢钠的含量 |