��Ŀ����
6������������Ư�ס���Ƶȷ���Ӧ�ù㷺������ľ̿��Ũ���ᡢˮ��ͭΪԭ�����ɵ�һ��������������Ʒ�Ӧ�Ʊ��������Ƶ�װ����ͼ1��ʾ�����ּг�װ���ԣ�����֪��
��3NaNO2+3HCl�T3NaCl+HNO3+2NO��+H2O
�����������£�NO��NO3-������MnO4-��Ӧ����NO3-��Mn2+��
���������գ�
��1��д��a���������Ʒ�Һ©����
��2��Ϊ����B���ݳ��������л��е�����������Na2O2��Ӧ��Ӧ��B��Cװ�ü�����һ��װ�ã����װ����ʢ�ŵ�ҩƷ����Ϊ��ʯ�ң����������ƹ���������ƹ��壩��
��3��д��NO��Na2O2�ڳ���������NaNO2�Ļ�ѧ��Ӧ����ʽ2NO+Na2O2=2NaNO2�����÷�Ӧ��ת��0.1mole-ʱ�����������ձ�״����NO�����Ϊ2.24L��
��4����11.7g����������ȫת�����������ƣ�������������Ҫľ̿1.8g��
��5��NO2������ˮ�������ΪV mL���Թܳ���NO2����ˮ�У���ͼ2��
��NO2����ˮ�Ļ�ѧ����ʽ��3NO2+H2O�T2HNO3+NO��
��ʹ�Թ���NO2��ȫ��ˮ���յIJ����ǻ���ͨ��$\frac{V}{4}$mL������
���� Aװ����C��HNO3��Ũ����Ӧ���ɶ�����̼���������������������B����ˮ��Ӧ�����ᣬ������Cu��Ӧ����NO��Cװ�����Ʊ�NaNO2�����ڶ�����̼��ˮ������������Ʒ�Ӧ�ĵõ�̼���ơ��������ƣ�����Ҫ��Ҫ��ȥ������̼��������NO���壬������B��C֮������ʢ�ż�ʯ�ҵ�װ�ã���Ӧ��ʼ��Ҫ�ž�װ���еĿ�������ֹ������NO�������������Ը��������Һ��Һ����δ��Ӧ��NO�����Է�ֹ��Ⱦ����������Ŀ��Ϣ�����������£�NO����MnO4-��Ӧ����NO3-��Mn2+��
��1��������a�Ľṹ��������֪����aΪ��Һ©����
��2��B��Cװ�ü�����һ��װ�ø���NO������ȥ���еĶ�����̼��
��3��NO��Na2O2�ڳ���������NaNO2����Ӧ��NԪ�ر�������OԪ�ر���ԭ����ƽ��д����ʽ�����NԪ�ػ��ϼ۱仯������NO�����ʵ�������������NO�������
��4������C+4HNO3��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$CO2��+4NO2��+2H2O��3NO2+H2O=2HNO3+NO���й�ϵʽC��4NO2��$\frac{4}{3}$NO��$\frac{8}{3}$HNO3������3Cu+8HNO3=3Cu��NO3��2+2NO��+4H2O���й�ϵʽHNO3��$\frac{3}{8}$Cu��$\frac{1}{4}$NO������C��$\frac{2}{3}$NO������̼���ܵ�NO�Ĺ�ϵʽΪC����$\frac{4}{3}$+$\frac{2}{3}$��NO������2NO+Na2O2�T2NaNO2����֪̼��Na2O2�Ĺ�ϵʽΪC��Na2O2��
��5����NO2��ˮ��Ӧ����һ�����������
������һ��������������Ӧ���ɶ�������������ͨ������ʹNO2��ȫ��ˮ�����4NO2+H2O+O2�T4HNO3����ͨ�����������
��� �⣺Aװ����C��HNO3��Ũ����Ӧ���ɶ�����̼���������������������B����ˮ��Ӧ�����ᣬ������Cu��Ӧ����NO��Cװ�����Ʊ�NaNO2�����ڶ�����̼��ˮ������������Ʒ�Ӧ�ĵõ�̼���ơ��������ƣ�����Ҫ��Ҫ��ȥ������̼��������NO���壬������B��C֮������ʢ�ż�ʯ�ҵ�װ�ã���Ӧ��ʼ��Ҫ�ž�װ���еĿ�������ֹ������NO�������������Ը��������Һ��Һ����δ��Ӧ��NO�����Է�ֹ��Ⱦ����������Ŀ��Ϣ�����������£�NO����MnO4-��Ӧ����NO3-��Mn2+��
��1������װ��ͼ��֪a����������Ϊ��Һ©�����ʴ�Ϊ����Һ©����
��2����Ϊһ�������л��ж�����̼��ˮ������������̼�������Ʒ����ķ�Ӧ����̼���ƺ�������ˮ��������Ʒ�Ӧ�����������ƣ�Ϊ���������Щ�����Ӧ��B��Cװ�ü�����װ��װ��ʯ�ң����������ƹ���������ƹ��壩���������ն�����̼��ˮ������
�ʴ�Ϊ����ʯ�ң����������ƹ���������ƹ��壩��
��3�����ݵ��ӵ�ʧ�غ㼰Ԫ���غ㣬��֪NO��Na2O2�ڳ���������NaNO2�ķ���ʽΪ��2NO+Na2O2=2NaNO2����Ӧ��NԪ�ػ��ϼ���+2������Ϊ+3�ۣ�����Ӧ��ת��0.1mole-ʱ������NO�����ʵ���Ϊ0.1mol����NO�����Ϊ2.24L��
�ʴ�Ϊ��2NO+Na2O2=2NaNO2��2.24��
��4������C+4HNO3��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$CO2��+4NO2��+2H2O��3NO2+H2O=2HNO3+NO���й�ϵʽC��4NO2��$\frac{4}{3}$NO��$\frac{8}{3}$HNO3������3Cu+8HNO3=3Cu��NO3��2+2NO��+4H2O���й�ϵʽHNO3��$\frac{3}{8}$Cu��$\frac{1}{4}$NO������C��$\frac{2}{3}$NO������̼���ܵ�NO�Ĺ�ϵʽΪC����$\frac{4}{3}$+$\frac{2}{3}$��NO������2NO+Na2O2�T2NaNO2����֪̼��Na2O2�Ĺ�ϵʽΪC��Na2O2������11.7g����������ȫת����Ϊ�������ƣ�������������Ҫ̼������Ϊ$\frac{11.7}{78}$��12g=1.8g��
�ʴ�Ϊ��1.8��
��5����NO2��ˮ��Ӧ����һ�����������ᣬ��Ӧ����ʽΪ3NO2+H2O�T2HNO3+NO��
�ʴ�Ϊ��3NO2+H2O�T2HNO3+NO��
������һ��������������Ӧ���ɶ�����������Ϸ�Ӧ4NO2+H2O+O2�T4HNO3������Ҫʹ���Թ���NO2��ȫ��ˮ���տ����Թ��л���ͨ��$\frac{V}{4}$mL������
�ʴ�Ϊ������ͨ��$\frac{V}{4}$mL������
���� ���⿼�������Ʊ�ʵ�鷽������ƣ��漰��ԭ����װ�õķ������ۡ���ѧ����ȣ���4���м���Ϊ�״��㡢�ѵ㣬�ؼ��Ǹ��ݷ���ʽ����Bװ���еõ�NO��̼�����ʵ�����ϵ��

| A�� | Ԫ��X��Ԫ��Y���γ����ӻ����� | |
| B�� | ԭ������Ϊ��X��Y��Z | |
| C�� | Ԫ��Z����������Ӧˮ����������� | |
| D�� | Ԫ��Y�γɵ���̬�⻯��ˮ��Һ��ǿ���� |
| A�� | C2H4 | B�� | C12H22O11 | C�� | C60 | D�� | HCOOH |
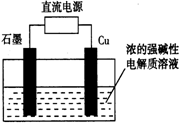 Cu2O���ɵ����ȡ����ͼ��ʾ������ܷ�Ӧ��2Cu+H2O=Cu2O+H2��������˵����ȷ���ǣ�������
Cu2O���ɵ����ȡ����ͼ��ʾ������ܷ�Ӧ��2Cu+H2O=Cu2O+H2��������˵����ȷ���ǣ�������| A�� | ʯī�缫�ϲ������� | B�� | ͭ�缫������ԭ��Ӧ | ||
| C�� | ͭ�缫��ֱ����Դ�ĸ��� | D�� | �÷�ӦҲ�����Ϊԭ��� |
| A�� | m��n=2��1 | B�� | m=2x | C�� | x��m��n=1��2��1 | D�� | m=2x+2 |
| A�� | 뮣�2H��ԭ�Ӻ�����1������ | |
| B�� | 1H��2H�Dz�ͬ�ĺ��� | |
| C�� | 1H218O��2H216O����Է���������ͬ | |
| D�� | 1H2O��2H2O��Ϊͬλ�� |
| A�� | Na��Mg��Alԭ�������������������࣬������ӵ�������������ǿ | |
| B�� | P��S��Cl��������ϼ��������ߣ���Ӧ����̬�⻯����ȶ���������ǿ | |
| C�� | C��N��Oԭ�Ӱ뾶�������� | |
| D�� | Na��K��Rb�������ˮ�������������ǿ |
 Cr��OH��3+3H+����Һ��H+�ŵ磬c��H+���½���ƽ�������ƶ���ʹCr3+�γ�Cr��OH��3���������������Һ��c��Fe3+��Ϊ1.3��10-13mol/L������Һ��Cr3+Ũ��Ϊ3.0��10-5mol/L��
Cr��OH��3+3H+����Һ��H+�ŵ磬c��H+���½���ƽ�������ƶ���ʹCr3+�γ�Cr��OH��3���������������Һ��c��Fe3+��Ϊ1.3��10-13mol/L������Һ��Cr3+Ũ��Ϊ3.0��10-5mol/L��