题目内容
8.氮可形成多种化合物,如NH3、NO2、N2O4等气体.已知NO2和N2O4的结构式分别是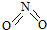 和
和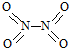 .已知:N-N键能为167kJ•mol-1,NO2中N=O键能为466kJ•mol-1,N2O4中N=O键能为438.5kJ•mol-1.
.已知:N-N键能为167kJ•mol-1,NO2中N=O键能为466kJ•mol-1,N2O4中N=O键能为438.5kJ•mol-1.(1)写出N2O4转化为NO2的热化学方程式:N2O4(g)=2NO2(g)△H=+57kJ•mol-1.
(2)在100℃时,将0.40mol的NO2气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.050 | n2 | 0.080 | 0.080 |
②n3=n4(填“>”、“<”或“=”),反应2NO2?N2O4的平衡常数K的数值为2.8(精确到小数点后两位),升高温度后,该反应的平衡常数K将减小(填“增大”、“减小”或“不变”).
③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是0.10mol•L-1.
(3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料.电池的总反应为4NH3(g)+3O2(g)=2N2(g)+6H2O(g),则该燃料电池的负极反应式:2NH3+6OH--6e-=N2+6H2O.
分析 (1)反应热等于反应物的总键能减去生成物的总键能计算反应热,根据热化学方程式的书写要求来书写;
(2)①根据公式反应速率v=$\frac{△c}{t}$来计算;
②化学平衡状态时,各组分的浓度不再随时间的改变而改变;反应2NO2?N2O4的平衡常数K=$\frac{[{N}_{2}{O}_{4}]}{[{N{O}_{2}]}^{2}}$,温度升高,平衡体系向着吸热的方向进行,判断K的变化情况;
③根据各组分的浓度变化量之比等于系数值比来计算;
(3)原电池负极发生氧化反应,氨气在负极失去电子,碱性条件下生成氮气与水.
解答 解:(1)反应热等于反应物的总键能减去生成物的总键能,则反应热△H为:△H=(167KJ/mol+4×438.5KJ/mol)-(2×2×466KJ/mol)=+57KJ/mol,
反应的热化学方程式为:N2O4(g)?2NO2(g)△H=+57 kJ•mol-1;
故答案为:N2O4(g)?2NO2(g)△H=+57kJ•mol-1;
(2)①从反应开始直至20s时,四氧化二氮的平均反应速率v=$\frac{△c}{△t}$=$\frac{\frac{0.05mol}{2L}}{20s}$=0.00125mol/(L•s),二氧化氮的平均反应速率为四氧化二氮的平均反应速率的2倍,即为0.0025mol•(L•s)-1,故答案为:0.0025;
②在60s时,反应已达平衡状态,所以n3=n4,当四氧化二氮的浓度为$\frac{0.08mol}{2L}$=0.04mol/L时,二氧化氮的浓度是:$\frac{0.4mol}{2L}$=0.12mol/L,
反应的平衡常数K=$\frac{0.04}{0.1{2}^{2}}$≈2.8,反应2NO2?N2O4是放热反应,升高温度,平衡左移,所以K减小,故答案为:=;2.8;减小;
③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是c,则
N2O4 ?2NO2
起始浓度(mol•L-1) c 0
转化浓度(mol•L-1)c-0.04 0.12
平衡浓度(mol•L-1)0.04 0.12
所以$\frac{c-0.04}{0.12}$=$\frac{1}{2}$,解得c=0.10,故答案为:0.10;
(3)原电池负极发生氧化反应,氨气在负极失去电子,碱性条件下生成氮气与水,负极电极反应式为:2NH3+6OH--6e-=N2+6H2O,
故答案为:2NH3+6OH--6e-=N2+6H2O.
点评 本题是一道化学平衡的综合题,既考查了热化学方程式的书写,又考查了化学平衡的有关问题,考查角度广,难度大.

 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案| A. | 60gHCHO和CH3COOH的混合物中存在的π键与σ键的数目总数为8NA | |
| B. | 2L0.5mol•L-1CH3COOD(D为重氢原子)溶液中,CH3COOD和DHO的微粒数之和为NA | |
| C. | 28g核素${\;}_{7}^{14}$N发生下列变化:${\;}_{7}^{14}$+${\;}_{0}^{1}$n→${\;}_{6}^{14}$+${\;}_{1}^{1}$H,通过该化学反应能生成2NA个${\;}_{1}^{1}$H | |
| D. | 450℃时,在催化剂作用下,将2molSO2与一定量的O2混合一段时间后测得SO2消耗$\frac{1}{2}$,则该正反应消耗了NA个SO2分子. |
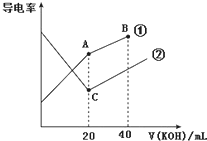 电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点.如图是某同学用0.1mol•L-1 KOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1的HCl和CH3COOH溶液滴定曲线示意图(混合溶液体积变化忽略不计).下列有关判断不正确的是( )
电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点.如图是某同学用0.1mol•L-1 KOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1的HCl和CH3COOH溶液滴定曲线示意图(混合溶液体积变化忽略不计).下列有关判断不正确的是( )| A. | 曲线①代表0.1 mol•L-1 KOH溶液滴定CH3COOH溶液的滴定曲线 | |
| B. | 在相同温度下,C点水电离的c(H+)大于A点水电离的c(H+) | |
| C. | 在A点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)═0.05 mol•L-1 | |
| D. | 在B点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+) |
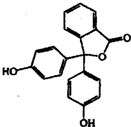 苯酚与邻苯二甲酸酐(
苯酚与邻苯二甲酸酐(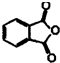 )在一定条件下反应可制得酚酞,酚酞的分子结构如图所示,下列说法正确的是( )
)在一定条件下反应可制得酚酞,酚酞的分子结构如图所示,下列说法正确的是( )| A. | 上述制酚酞的反应属于取代反应 | |
| B. | 酚酞分子中的碳原子有可能共处于同一平面 | |
| C. | 若与NaOH溶液反应.1mol酚酞最多可消耗4 molNaOH | |
| D. | 将酚酞溶于酒精配成的酚酞试剂.滴入中性或酸性水溶液中可能会出现白色浑浊 |
| 化学式 | 电离常数 |
| CH3COOH | Ka=1.76×10-5 |
| H2SO3 | ${K_{a_1}}$=1.54×10-2 |
| ${K_{a_2}}$=1.02×10-7 | |
| HF | Ka=6.03×10-4 |
| A. | 1mol•L-1NaHA溶液中一定存在:c(Na+)=c(H2A)+c(HA-)+c(A2-) | |
| B. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | pH均等于3的醋酸与盐酸溶液等体积混合后,溶液的pH变大 | |
| D. | 已知某温度下常见弱酸的电离平衡常数如表:相同物质的量浓度的CH3COONa、NaF、Na2SO3、NaHSO3水溶液,溶液中离子总数由小到大排列的顺序是Na2SO3<CH3COONa<NaF<NaHSO3 |
| 加入的物质 | 结论 | |
| A | 少量Ba(OH)2 | 反应结束后,c(CO32-)减小 |
| B | 再加入等量Na2CO3 | 溶液中c(CO32-)<c(HCO3-) |
| C | 100mLH2O | 由水电离出的c(H+)•c(OH-)不变 |
| D | 冰醋酸 | $\frac{c(C{O}_{3}^{2-})}{c(HC{{O}_{3}}^{-})}$增大 |
| A. | A | B. | B | C. | C | D. | D |
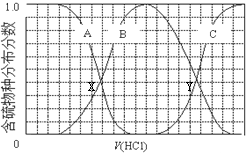
| A. | 含硫物种B表示HS- | |
| B. | 在滴加盐酸过程中,溶液中c(Na+)与含硫各物种浓度的大小关系为:c(Na+)=3[c(H2S)+c(HS-)+c(S2-)] | |
| C. | X,Y为曲线的两交叉点,若能知道X点处的pH,就可以计算出H2S的Ka值 | |
| D. | NaHS呈碱性,若向溶液中加入CuSO4溶液,恰好完全反应,所得溶液呈强酸性,其原因是Cu2++HS-═CuS↓+H+ |
 .
.