题目内容
4.相同条件下,下列碱溶液的pH值最大的是( )| A. | 0.1mol/L氢氧化钠溶液 | B. | 0.1mol/L氢氧化钡溶液 | ||
| C. | 0.1mol/L氢氧化钾溶液 | D. | 0.1mol/L氨水 |
分析 弱碱在溶液中部分电离,强碱在溶液中完全电离,溶液中氢氧根离子的浓度越大,溶液的pH越大,据此分析.
解答 解:A.0.1mol/L氢氧化钠溶液,氢氧根离子的浓度为0.1mol/L;
B.0.1mol/L氢氧化钡溶液,氢氧根离子的浓度为0.2mol/L;
C.0.1mol/L氢氧化钾溶液,氢氧根离子的浓度为0.1mol/L;
D.0.1mol/L氨水中,一水合氨部分电离,氢氧根离子的浓度小于0.1mol/L;
所以氢氧根离子浓度最大的是氢氧化钡溶液,故B符合;
故选B.
点评 本题考查了溶液酸碱性的判断,题目难度不大,掌握常见物质的酸碱性、溶液的酸碱性和溶液pH大小之间的关系是顺利解题的关键,侧重于考查学生对基础知识的应用能力.

练习册系列答案
相关题目
14.下列关于同温同压下的两种气体 12C18O和14N2的判断不正确的是( )
| A. | 体积相等时密度不相等 | B. | 原子数相等时具有的中子数不相等 | ||
| C. | 体积相等时具有的电子数相等 | D. | 质量相等时具有的质子数相等 |
15.利用下列反应不能制得括号中纯净物的是 ( )
| A. | 等物质的量氯气与乙烷在光照条件下反应(氯乙烷) | |
| B. | 乙烯与水加成(乙醇) | |
| C. | 乙烯与氯气加成(1,2-二氯乙烷) | |
| D. | 乙烯与氢气加成(乙烷) |
12.已知25℃时,Ka(HF)=3×10-4,Ksp(CaF2)=1.46×10-10.现向1L0.2mol•L-1HF溶液中加入1L0.2mol•L-1CaCl2溶液,则下列说法中正确的是( )
| A. | 25℃时,0.1mol•L-1HF溶液中pH=1 | |
| B. | Ksp(CaF2)随温度和浓度的变化而变化 | |
| C. | 该体系中没有沉淀产生 | |
| D. | 该体系中HF与CaCl2反应产生沉淀 |
16.下列化学用语使用科学规范的是( )
| A. | 35Cl和37Cl的原子结构示意图均为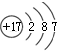 | |
| B. | HCI的形成过程为 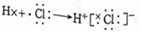 | |
| C. | 乙烯的结构简式为CH2CH2 | |
| D. | 草酸的电离过程为H2C2O4?2H++C2O42- |
13.最新研究表明,以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,下列有关说法正确的是( )
| A. | 乙酸是非电解质 | |
| B. | 上述制备乙酸的化学方程式为CO2+CH4$\stackrel{Cu_{2}Al_{2}O_{2}}{→}$CH3COOH | |
| C. | 上述制备乙酸的反应中原子利用率为80% | |
| D. | 乙酸没有同分异构体 |
15.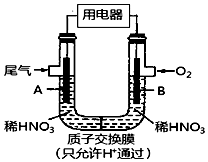 某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔导电材料.下列说法一定正确的是( )
某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔导电材料.下列说法一定正确的是( )
 某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔导电材料.下列说法一定正确的是( )
某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔导电材料.下列说法一定正确的是( )| A. | 该电池工作时,电子的流向外电路由A到B,内电路由B到A形成闭合回路 | |
| B. | 电极B附近的HNO3浓度增大 | |
| C. | A电极的反应为:NO2-e-+H2O═NO3-+2H+,NO-3e-+2H2O═NO3-+4H+ | |
| D. | 该电池工作时,每消耗11.2L O2(标准状况下),可以除去含1mol NO和NO2的混合尾气 |


