题目内容
8.含C、N化合物在生产、生活中有着重要的作用.请按要求回答下列问题.N在元素周期表中的位置:第二周期VA族.元素C、N最简单气态氢化物的稳定性强弱比较(填化学式):CH4<NH3.
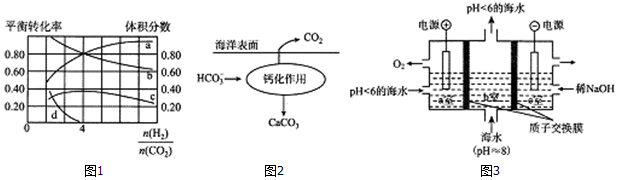
I.氨气应用于侯德榜制碱工艺,原理如图1所示:
(1)过程i通入NH3和CO2的顺序是先通NH3,后通CO2.
(2)过程ii有利于析出更多NH4Cl(s)的原因是NH4Cl(s)?NH4+(aq)+Cl-(aq),增大c(Cl-),平衡左移,促进NH4Cl析出.
(3)制碱副产品NH4Cl可用于生产NH3和HCl.但直接加热分解NH4Cl,NH3和HCl的产率很低,原因是(用化学方程式表示)NH3+HCl=NH4Cl. 而采用在N2氛围中,将MgO与NH4Cl混合加热至300℃,可获得高产率的NH3,该反应的化学方程式为MgO+2NH4Cl$\frac{\underline{\;300℃\;}}{\;}$2NH3↑+MgCl2+H2O↑.
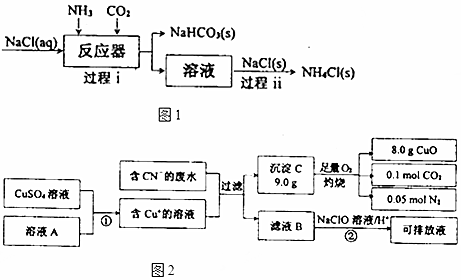
Ⅱ.电镀工业中含CN-的废水在排放前的处理过程如图2:
(1)溶液A具有的性质是(填“氧化性”或“还原性”)还原性.C的化学式为:CuCN.
(2)反应②可将CN-转化为无害物质,其离子方程式为:2CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O.
分析 N的原子序数为7,原子核外有2个电子层,最外层电子数为5,以此确定在周期表中的位置,元素的非金属性越强,对应的氢化物越稳定;
I.(1)使溶液在碱性环境下,二氧化碳的溶解度增大;
(2)NH4Cl的溶解平衡:NH4Cl(s)?NH4+(aq)+Cl-(aq),增大c(Cl-),平衡逆向移动;
(3)氨气与氯化氢易生成氯化铵;将MgO与NH4Cl混合加热至300℃,可获得高产率的NH3,由质量守恒可知还生成氯化镁、水;
II.(1)溶液A与硫酸铜反应生成亚铜离子,说明具有还原性;C灼烧生成CuO、二氧化碳、氮气,可说明C含有Cu、C、N元素,结合物质的量的关系可确定C的化学式;
(2)反应②可将CN-转化为无害物质,被NaClO氧化生成二氧化碳、氮气等.
解答 解:N的原子序数为7,原子核外有2个电子层,最外层电子数为5,位于周期表第二周期VA族,非金属性N>C,元素的非金属性越强,对应的氢化物越稳定,则稳定性CH4<NH3,
故答案为:第二周期VA族;CH4<NH3;
I.(1)先通NH3使溶液呈碱性,这样可增大CO2 的溶解度,产生更多的NaHCO3,
故答案为:先通NH3,后通CO2;
(2)NH4Cl的溶解平衡:NH4Cl(s)?NH4+(aq)+Cl-(aq),增大c(Cl-),平衡左移,促进氯化铵析出,
故答案为:NH4Cl(s)?NH4+(aq)+Cl-(aq),增大c(Cl-),平衡左移,促进NH4Cl析出;
(3)氨气与氯化氢相遇又结合成氯化铵,发生NH3+HCl=NH4Cl;加热条件下,MgO和氯化铵反应生成氨气、氯化镁和水,方程式为MgO+2NH4Cl $\frac{\underline{\;300℃\;}}{\;}$ 2NH3↑+MgCl2+H2O↑,
故答案为:NH3+HCl=NH4Cl;MgO+2NH4Cl $\frac{\underline{\;300℃\;}}{\;}$ 2NH3↑+MgCl2+H2O↑;
II.(1)溶液A与硫酸铜反应生成亚铜离子,说明具有还原性;C灼烧生成CuO、二氧化碳、氮气,可说明C含有Cu、C、N元素,由题给数据可知n(CuO)=$\frac{8.0g}{80g/mol}$=0.1mol,n(CO2)=0.1mol,n(N2)=0.05mol,则n(Cu)=0.1mol、n(C)=0.1mol、n(N)=0.1mol,且m(Cu)+m(C)+m(N)=0.1mol×64g/mol+0.1mol×12g/mol+0.1mol×14g/mol=9g,所以化学式为CuCN,
故答案为:还原性;CuCN;
(2)反应②可将CN-转化为无害物质,被NaClO氧化生成二氧化碳、氮气等,方程式为2CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O,
故答案为:2CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O.
点评 本题考查纯碱工业知识以及废水的处理,为高频考点,侧重考查学生的分析能力、计算能力和实验能力,注意把握物质的性质以及实验的流程,易错点为II.(1),注意从质量守恒的角度判断化学式,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 35Cl和37Cl的原子结构示意图均为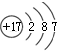 | |
| B. | HCI的形成过程为 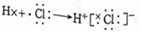 | |
| C. | 乙烯的结构简式为CH2CH2 | |
| D. | 草酸的电离过程为H2C2O4?2H++C2O42- |
| A. | 乙酸是非电解质 | |
| B. | 上述制备乙酸的化学方程式为CO2+CH4$\stackrel{Cu_{2}Al_{2}O_{2}}{→}$CH3COOH | |
| C. | 上述制备乙酸的反应中原子利用率为80% | |
| D. | 乙酸没有同分异构体 |
| 编号 | 2%CuSO4溶液的体积 | 10%NaOH溶液的体积 | 振荡后的现象 | pH | 加乙醛水浴加热后的沉淀颜色 |
| 1 | 2mL | 3滴 | 浅蓝绿色沉淀 | 5~6 | 浅蓝绿色沉淀 |
| 2 | a | 15滴 | 浅蓝色沉淀 | 7~8 | 黑色沉淀 |
| 3 | 1mL | 1mL | 蓝色悬浊沉淀较少 | 9~10 | 红褐色沉淀 |
| 4 | b | 2mL | 蓝色悬浊沉淀较多 | 11~12 | 红色沉淀 |
| 5 | 1mL | 3mL | 蓝紫色溶液 | 12~13 | ---- |
A.15滴,1mL B.2mL,1mL C.15滴,2mL D.2mL,2mL
(2)查阅资料可知,实验1中的浅蓝绿色沉淀主要成份为Cu2(OH)2SO4,受热不易分解.写出生成Cu2(OH)2SO4反应的化学方程式2NaOH+2CuSO4═Cu2(OH)2SO4↓+Na2SO4.基于实验1、2的现象可以得出结论:NaOH用量较少时,乙醛未参与氧化反应,(或是含铜元素的化合物在发生变化).
(3)小组同学推测实验3中的红褐色沉淀可能是CuO和Cu2O的混合物,其依据是依据现象提出依据:实验2中的黑色沉淀可能是CuO;实验4中的红色沉淀可能是Cu2O,所以实验3中的红褐色沉淀,可能是CuO和Cu2O的混合物.
依据理论提出依据:当NaOH用量逐渐增多时,产生的Cu(OH)2一部分受热分解生成黑色的CuO;另一部分被乙醛还原为Cu2O红色沉淀,所以实验3中的红褐色沉淀,可能是CuO和Cu2O的混合物.
(4)为了进一步证明实验4中红色沉淀的成分,该小组同学查阅资料得知:Cu2O在碱性条件下稳定,在酸性溶液中可转化为Cu2+、Cu.并进行了以下实验.
ⅰ.将实验4反应后的试管静置,用胶头滴管吸出上层清液.
ⅱ.向下层浊液中加入过量稀硫酸,充分振荡、加热,应观察到的现象是溶液变为蓝色,有红色固体.
(5)小组同学继续查阅资料得知:Cu(OH)2可与OH-继续反应生成蓝紫色溶液([Cu(OH)4]2-),由此提出问题:[Cu(OH)4]2-能否与乙醛发生反应,生成红色沉淀?设计实验解决这一问题,合理的实验步骤是将1mL2%CuSO4溶液与3mL(或>3mL)10%NaOH溶液混合振荡后(或取实验5的蓝紫色溶液),加入0.5mL40%的乙醛溶液,水浴加热.基于上述实验,该小组同学获得结论:乙醛参与反应生成红色沉淀时,需控制体系的pH>10.
| A. | L层上的电子数为奇数的原子不一定是主族元素的原子 | |
| B. | 只由共价键形成的物质不一定是共价化合物 | |
| C. | 化学键的形成一定伴随着电子的转移和能量变化 | |
| D. | 元素周期表中,位于金属和非金属分界线附近的元素属于过渡元素 |
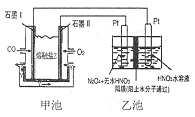 现以CO、O2、熔熔盐Z(Na2CO3)组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2,下列说法错误的是( )
现以CO、O2、熔熔盐Z(Na2CO3)组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2,下列说法错误的是( )| A. | 石墨I是原电池的负极,发生氧化反应 | |
| B. | 甲池中的CO32-向石墨I极移动 | |
| C. | 乙池中左端Pt极电极反应式:N2O4-2e-+2HNO3=2N2O5+2H+ | |
| D. | 若甲池消耗标准状况下的氧气2.24L,则乙池中产生氢气0.05mol |