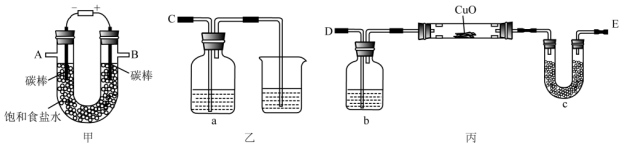
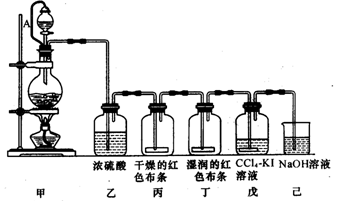
题目内容
8.下列有关电解质溶液的说法正确的是( )| A. | 向0.1 mol•L-1CH3COOH溶液中加入少量水,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$减小 | |
| B. | 在0.l mol•L-1的稀硫酸加水稀释的过程中,c(H+):c(SO42-)始终为2:1 | |
| C. | 向10 mL浓度为0.l mol•L-1CH3COOH溶液中滴加相同浓度的氨水至中性,在滴加过程中$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$逐渐减小 | |
| D. | 在含0.1mol NaHSO4溶液中:c(H+)<c(SO42-)+c(OH-) |
分析 A.CH3COOH溶液中加入少量水,促进电离,n(H+)增大,n(CH3COOH)减小;
B.加水稀释的过程中,pH≤7时,c(H+):c(SO42-)始终为2:1,但继续稀释时c(H+)≈10-7mol/L,c(SO42-)继续减小;
C.滴加相同浓度的氨水至中性,溶质为醋酸铵,pH增大,c(OH-)增大,但K=$\frac{c(N{H}_{4}^{+})c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不变;
D.由电荷守恒可知c(Na+)+c(H+)=2c(SO42-)+c(OH-),由物料守恒可知c(Na+)=c(SO42-).
解答 解:A.CH3COOH溶液中加入少量水,促进电离,n(H+)增大,n(CH3COOH)减小,则溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$增大,故A错误;
B.加水稀释的过程中,pH≤7时,c(H+):c(SO42-)始终为2:1,但继续稀释时c(H+)≈10-7mol/L,c(SO42-)继续减小,则无限稀释时比值不是2:1,故B错误;
C.滴加相同浓度的氨水至中性,溶质为醋酸铵,pH增大,c(OH-)增大,但K=$\frac{c(N{H}_{4}^{+})c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不变,则滴加过程中$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$逐渐减小,故C正确;
D.由电荷守恒可知c(Na+)+c(H+)=2c(SO42-)+c(OH-),由物料守恒可知c(Na+)=c(SO42-),则c(H+)=c(SO42-)+c(OH-),故D错误;
故选C.
点评 本题考查弱电解质的电离平衡,为高频考点,把握电离平衡移动、平衡常数及物料守恒和电荷守恒为解答的关键,侧重分析与应用能力的考查,注意选项B为易错点,题目难度不大.

| 选项 | 实验操作 | 现 象 | 结 论 |
| A | 向亚硫酸钠试样中滴入盐酸酸化的Ba(ClO)2溶液 | 生成白色沉淀 | 试样己氧化变质 |
| B | 向Co2O3中滴入浓盐酸 | 产生黄绿色气体 | 氧化性:Co2O3>Cl2 |
| C | 向待测液中依次滴入氯水和KSCN溶液 | 溶液变为红色 | 待测溶液中含有Fe2+ |
| D | 向Na2SO4和Na2CO3混合溶液中滴入AgNO3溶液 | 产生白色沉淀 | Ksp(Ag2SO4)<Ksp(Ag2CO3) |
| A. | A | B. | B | C. | C | D. | D |
| 容器编号 | 起始时各物质的物质的量/mol | 平衡时反应中的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 2 | 3 | 0 | 放出热量b kJ |
| ③ | 2 | 6 | 0 | 放出热量c kJ |
| A. | 反应的平衡常数:③>①>② | |
| B. | 达到平衡时氨气的体积分数:①>③ | |
| C. | 放出的热量(kJ):a<b<92.4 | |
| D. | 反应得到1mol NH3(l),放出热量46.2kJ |
| A. | 10mL0.4mol/L的盐酸 | B. | 10mL0.3mol/LMgCl2溶液 | ||
| C. | 10mL0.5mol/LNaCl溶液 | D. | 10mL0.1mol/LAlCl3溶液 |
| A. |  用装置制取NO | |
| B. |  用装置收集NO | |
| C. |  用装置分离炭粉和硝酸铜溶液 | |
| D. |  用装置蒸干硝酸铜溶液制Cu(NO3)2•3H2O |
| 选项 | A | B | C | D |
| 生活中的应用 |  月饼袋内放有小袋铁粉 |  口服补血剂(琥珀酸亚铁)并同时服维生C |  饼干包装盒内放有小袋硅胶 |  肉制品中添加适量的亚硝酸钠 |
| 作用 | 铁粉有抗氧化的作用 | 维生素C有防止Fe2+被还原的作用 | 硅胶有吸水的作用 | 亚硝酸钠有防腐的作用 |
| A. | A | B. | B | C. | C | D. | D |