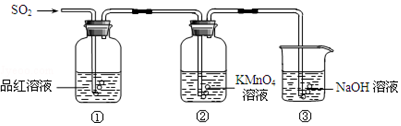
题目内容
17.下列装置应用于实验室制NO并回收硝酸铜的实验,能达到实验目的是( )| A. |  用装置制取NO | |
| B. |  用装置收集NO | |
| C. |  用装置分离炭粉和硝酸铜溶液 | |
| D. |  用装置蒸干硝酸铜溶液制Cu(NO3)2•3H2O |
分析 A.生成气体从长颈漏斗逸出,且NO易被氧化;
B.NO不能用排空气法收集;
C.炭粉不溶于水,硝酸铜溶于水;
D.蒸发时促进铜离子水解,生成硝酸易挥发.
解答 解:A.生成气体从长颈漏斗逸出,且NO易被氧化,则不能制备NO,应选分液漏斗,故A错误;
B.NO不能用排空气法收集,应选排水法收集,故B错误;
C.炭粉不溶于水,硝酸铜溶于水,则利用图中过滤装置可分离,故C正确;
D.蒸发时促进铜离子水解,生成硝酸易挥发,则蒸发不能制备,应选冷却结晶法,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、气体的制备和收集、盐类水解为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.某兴趣学习小组的同学就用如图5个装置进行常见物质的制取,并探究其性质(图中a、b、c表示止水夹),请对其进行完善或评价,试回答下列问题:
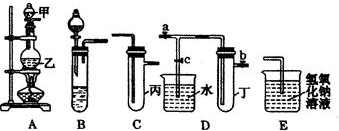
(1)将A、C、E相连后,以二氧化锰和浓盐酸(填写名称)为原料制取Cl2,仪器乙的名称是圆底烧瓶.
(2)利用(1)中装置和药品,在丙中加入适量水,即可制得氯水.将所得氯水分为两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象、结论如下:
实验Ⅰ获得结论不合理请说明理由:没有事先证明干燥的氯气无漂白性
实验Ⅱ获得结论是否合理?不合理(填“合理”或“不合理”).请写出产生气泡的离子方程式HCO3-+H+=CO2↑+H2O
(3)利用(1)中装置还可设计一个简单的实验比较Cl-和S2-的还原性强弱.若C中加入硫酸钾溶液,则C中预期出现的现象是产生淡黄色沉淀.
(4)将B、D、E装置相连接(打开止水夹a和止水夹b,关闭止水夹c),在B中盛装浓硝酸和铜片(将铜片放在有孔塑料板上),可制得NO2.一段时间后,欲用D装置探究NO2与水的反应,其操作步骤为:先关闭a、b,打开c再双手紧握(或微热)试管丁,使NO2逸出与水接触以使烧杯中的水进入试管丁,观察现象,E装置的作用是吸收尾气防止污染空气.

(1)将A、C、E相连后,以二氧化锰和浓盐酸(填写名称)为原料制取Cl2,仪器乙的名称是圆底烧瓶.
(2)利用(1)中装置和药品,在丙中加入适量水,即可制得氯水.将所得氯水分为两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象、结论如下:
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将所得氯水滴入品红溶液 | 品红溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 向所得氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气与水反应至少产生一种酸性强于碳酸的物质 |
实验Ⅱ获得结论是否合理?不合理(填“合理”或“不合理”).请写出产生气泡的离子方程式HCO3-+H+=CO2↑+H2O
(3)利用(1)中装置还可设计一个简单的实验比较Cl-和S2-的还原性强弱.若C中加入硫酸钾溶液,则C中预期出现的现象是产生淡黄色沉淀.
(4)将B、D、E装置相连接(打开止水夹a和止水夹b,关闭止水夹c),在B中盛装浓硝酸和铜片(将铜片放在有孔塑料板上),可制得NO2.一段时间后,欲用D装置探究NO2与水的反应,其操作步骤为:先关闭a、b,打开c再双手紧握(或微热)试管丁,使NO2逸出与水接触以使烧杯中的水进入试管丁,观察现象,E装置的作用是吸收尾气防止污染空气.
8.下列有关电解质溶液的说法正确的是( )
| A. | 向0.1 mol•L-1CH3COOH溶液中加入少量水,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$减小 | |
| B. | 在0.l mol•L-1的稀硫酸加水稀释的过程中,c(H+):c(SO42-)始终为2:1 | |
| C. | 向10 mL浓度为0.l mol•L-1CH3COOH溶液中滴加相同浓度的氨水至中性,在滴加过程中$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$逐渐减小 | |
| D. | 在含0.1mol NaHSO4溶液中:c(H+)<c(SO42-)+c(OH-) |
12.若NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1L 1mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 78g苯中含有C=C键的数目为3NA | |
| C. | 7.8gNa2O2固体中含有的离子总数为0.3NA | |
| D. | 标准状况下,将分子总数为NA的NO和O2充分混合后,所得混合气体的体积约为22.4L |
9.己知:S2O32-+2H+═SO2↑+S↓+H2O.探究化学反应速率的影响因素,以下实验浑浊出现最快的组别是( )
| 组别 | 温度/℃ | 0.1mol•L-I Na2S2O3/mL | 0,1mol•L-1 H2SO4/mL | 水/mL |
| A | 30 | 10 | 10 | 0 |
| B | 30 | 5 | 5 | 10 |
| C | 25 | 10 | 5 | 5 |
| D | 25 | 5 | 10 | 5 |
| A. | A | B. | B | C. | C | D. | D |
14. 在一定温度压强下,将H2和N2充入一体积为2L的密闭容器中.反应过程中H2、N2和NH3物质的量变化如图所示,下列说法正确的是( )
在一定温度压强下,将H2和N2充入一体积为2L的密闭容器中.反应过程中H2、N2和NH3物质的量变化如图所示,下列说法正确的是( )
 在一定温度压强下,将H2和N2充入一体积为2L的密闭容器中.反应过程中H2、N2和NH3物质的量变化如图所示,下列说法正确的是( )
在一定温度压强下,将H2和N2充入一体积为2L的密闭容器中.反应过程中H2、N2和NH3物质的量变化如图所示,下列说法正确的是( )| A. | 从曲线可以看出,反应进行到10 min时,改变的条件可能是降低温度 | |
| B. | 反应开始到第一次平衡,NH3的平均反应速率为0.005 mol/(L min) | |
| C. | 从曲线可以看出,反应进行到25min时,改变的条件是分离出0.1mol的氨气 | |
| D. | 在25 min时平衡正向移动但达到新平衡后NH3的物质的量百分含量比原来小 |