题目内容
18.A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P亚层中有3个未成对电 子,D元素原子核外的M层中只有2对成对电子.(1)当n=2时,AB2属于非极性分子(填“极性”或“非极性”),分子中有2个σ 键,2个π键.
(2)当n=3时,A与B形成的晶体属于原子晶体.
(3)若A元素的原子价电子排布为3s23p2,A、C、D三种元素的第一电离能由大到小的顺序是P>S>Si(用元素符号表示)
(4)已知某红紫色络合物的组成为CoCl3•5NH3•H2O.该络合物中的中心离子钴离子在基态时核外电子排布式为1s22s22p63s23p63d6 (或[Ar]3d6),作为配位体之一的NH3分子的空间构型为三角锥形.
分析 A,B,C,D均为前四周期元素,A元素的原子价电子排布为ns2np2,A为第IVA族元素;B元素的最外层电子数是其电子层数的3倍,B为O元素;
C元素原子的M电子层的P亚层中有3个未成对电子,则C原子的最外层电子排布式为3s23p3,所以C为P元素;
D元素原子核外的M层中只有2对成对电子,则D原子的最外层电子排布式为3s23p4,所以D为S元素.
(1)当n=2时,A为C元素,则AB2为CO2,根据分子的结构式分析;
(2)当n=3时,A为Si元素,A与B形成的是SiO2;
(3)若A元素的原子价电子排布为3s23p2,A为Si元素,同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,据此判断第一电离能大小顺序;
(4)Co原子序数为27,CoCl3•5NH3•H2O中的中心离子钴离子的带3个正电荷,以此来书写离子的电子排布式,NH3价层电子对为4,有一个孤电子对,结构为三角锥形.
解答 解:A,B,C,D均为前四周期元素,A元素的原子价电子排布为ns2np2,A为第IVA族元素;B元素的最外层电子数是其电子层数的3倍,B为O元素;
C元素原子的M电子层的P亚层中有3个未成对电子,则C原子的最外层电子排布式为3s23p3,所以C为P元素;
D元素原子核外的M层中只有2对成对电子,则D原子的最外层电子排布式为3s23p4,所以D为S元素;
(1)当n=2时,A是C元素,则AB2是CO2,二氧化碳是直线型结构,正负电荷重心重合,所以是非极性分子,CO2分子的结构式为O=C=O,则分子中有2个σ 键,2个π键,
故答案为:非极性;2、2;
(2)当n=3时,A是Si元素,硅和氧形成的晶体是二氧化硅晶体,二氧化硅晶体是由原子构成的,属于原子晶体,
故答案为:原子;
(3)若A元素的原子价电子排布为3s23p2,则A是Si元素,同一周期中,原子的电负性随着原子序数的增大而呈增大趋势,但第VA族元素大于第VIA族元素,所以A、C、D三种元素的第一电离能由大到小的顺序P>S>Si,
故答案为:P>S>Si;
(4)钴离子的化合价是+3价,钴离子核外有24个电子,其基态时核外电子排布式为1s22s22p63s23p63d6,NH3分子中N原子以sp3杂化,空间构型为三角锥或四面体,
故答案为:1s22s22p63s23p63d6 (或[Ar]3d6);三角锥形.
点评 本题考查了元素的推断、电离能大小的判断、核外电子排布式的书写等,题目难度中等,注意书写基态原子核外电子排布式时要根据构造原理,侧重于考查学生对基础知识的应用能力.

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案①硅是构成一些岩石和矿物的基本元素
②水泥、玻璃、水晶饰物都是硅酸盐制品
③高纯度的硅单质是良好的半导体材料
④陶瓷是人类应用很早的硅酸盐材料
⑤水玻璃可用于生产黏合剂和防火剂
⑥二氧化硅是一种原子晶体,用作光纤以及电脑芯片.
| A. | ①②③④ | B. | ②③⑤⑥ | C. | ①③④⑤ | D. | ②③④⑤ |
| A. | 化学反应中能量变化的大小与反应物的多少无关 | |
| B. | 化学反应必然伴随能量的变化 | |
| C. | 化学反应中能量的主要是由化学键变化引起的 | |
| D. | 能量变化是化学反应的基本特征之一 |
| A. | 用水鉴别炭粉和二氧化锰 | |
| B. | 用闻气味的方法鉴别白酒和白醋 | |
| C. | 用澄清石灰水鉴别氮气和二氧化碳 | |
| D. | 用相互刻画的方法鉴别黄铜片和铜片 |
| A. | Fe | B. | Cu | C. | Ag | D. | Al |
| A. | 葡萄糖 | B. | 氨基乙酸 | C. | 淀粉 | D. | 碳酸钠 |
①用氨水清洗做过银镜反应的试管
②不宜用瓷坩埚灼烧氢氧化钠固体
③使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤后烘干
④用酸式滴定管量取12.00mL高锰酸钾溶液
⑤使用pH试纸测定溶液pH时先润湿,测得溶液的pH都偏小
⑥配制FeSO4溶液时,需加入少量铁粉和稀硫酸.
| A. | ②④⑥ | B. | ②③⑥ | C. | ①②④ | D. | ②③④⑤⑥ |
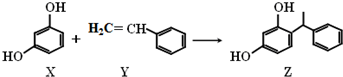
| A. | X、Y和Z均能与溴水发生反应,其中X、Z发生取代反应,Y发生加成反应 | |
| B. | X和Z均能NaOH溶液反应,也能与NaHCO3溶液反应放出CO2 | |
| C. | Y既能与H2发生加成反应,也能使酸性高锰酸钾溶液褪色 | |
| D. | Y可作加聚反应单体,X可作缩聚反应单体 |