题目内容
17.将 E 和 F 加入密闭容器中,在一定条件下发生反应:2E(g)+F(s)?G(g).忽略固体体积,平衡时 E的体积分数(%)随温度和压强的变化如下表所示.下列推断不正确的是( )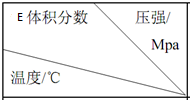 | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
| A. | 915℃,2.0 MPa 时 E 的转化率为 60% | |
| B. | K(810℃)>K(1000℃) | |
| C. | 该反应可在较低温度下自发进行 | |
| D. | e>d |
分析 A、在915℃、2M Pa下,设E的起始量为amol,转化率为x,则平衡时G的量为2ax,由题意得$\frac{2ax}{a-ax+2ax}$×100%=75%,解得x=0.6;
B、升温平衡逆向移动,则平衡常数降低;
C、该题是气体体积减小的反应,因此为熵减反应,同压下,升温E的体积分数增加,所以平衡逆向移动,即正反应为放热反应,根据△H-T△S判断反应能否自发进行;
D、同温下,增大压强,平衡正向进行,平衡时E的体积分数变小,故可知d<75.0<c,e>0.83.
解答 解:A、设E的起始量为amol,转化率为x,则平衡时G的量为2ax,由题意得$\frac{2ax}{a-ax+2ax}$×100%=75%,解得x=0.6,α=60%,故A错误;
B、同压下,升温,E的体积分数增加,所以平衡逆向移动,即正反应为放热反应,所以K(1000℃)<K(810℃),故B正确;
C、该反应是一个气体分子减小的反应,属于熵减反应,为放热反应,根据△H-T△S判断较低温度下自发进行,故C正确;
D、同温下,增大压强,平衡正向进行,平衡时E的体积分数变小,故可知d<75.0<c,e>0.83,e>d,故D正确;
故选A.
点评 本题考查化学平衡影响因素分析,数据处理的方法应用,平衡计算和对比判断是解题关键,题目难度中等.

练习册系列答案
 综合自测系列答案
综合自测系列答案
相关题目
7.下列各组溶液中离子,能在溶液中大量共存且溶液为澄清透明的是( )
| A. | K+、Cu2+、NO3-、OH- | B. | K+、Na+、Cl-、NO3- | ||
| C. | Ag+、Na+、Cl-、K+ | D. | Fe3+、K+、NO3-、SO42- |
8.下列关于硅单质及其化合物的说法正确的是( )
①硅是构成一些岩石和矿物的基本元素
②水泥、玻璃、水晶饰物都是硅酸盐制品
③高纯度的硅单质是良好的半导体材料
④陶瓷是人类应用很早的硅酸盐材料
⑤水玻璃可用于生产黏合剂和防火剂
⑥二氧化硅是一种原子晶体,用作光纤以及电脑芯片.
①硅是构成一些岩石和矿物的基本元素
②水泥、玻璃、水晶饰物都是硅酸盐制品
③高纯度的硅单质是良好的半导体材料
④陶瓷是人类应用很早的硅酸盐材料
⑤水玻璃可用于生产黏合剂和防火剂
⑥二氧化硅是一种原子晶体,用作光纤以及电脑芯片.
| A. | ①②③④ | B. | ②③⑤⑥ | C. | ①③④⑤ | D. | ②③④⑤ |
5.某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原产物,当参加反应的单质与被还原硝酸的物质的量之比为3:2时,还原产物可能是( )
| A. | NO2 | B. | NO | C. | N2O | D. | N2 |
6.下列说法错误的是( )
| A. | 化学反应中能量变化的大小与反应物的多少无关 | |
| B. | 化学反应必然伴随能量的变化 | |
| C. | 化学反应中能量的主要是由化学键变化引起的 | |
| D. | 能量变化是化学反应的基本特征之一 |