题目内容
2.下列分子中,所有原子最外层均为 8 电子结构的是( )| A. | CO2 | B. | BF3 | C. | LiCl | D. | NH3 |
分析 判断的技巧:原子的最外层电子数+化合价绝对值=8,则该原子的最外层为8电子结构.
解答 解:A.碳原子和氧原子的最外层电子数+化合价绝对值为8,则原子的最外层均为8电子结构,故A正确;
B.硼原子最外层电子数(3)+化合价绝对值(3)为6,硼原子最外层为6电子结构,而不是8电子结构,故B错误;
C.锂离子最外层只有2个电子,而不是8电子结构,故C错误;
D.氮原子最外层电子数(5)+化合价绝对值(3)为8,则氮原子的最外层为8电子结构,但氢原子是2电子结构,故D错误;
故选A.
点评 本题是对学生原子结构知识的考查,注意规律性的知识在解决选择题中的作用和地位,难度中等.

练习册系列答案
相关题目
13.下列有关物质的鉴别方案错误的是( )
| A. | 用水鉴别炭粉和二氧化锰 | |
| B. | 用闻气味的方法鉴别白酒和白醋 | |
| C. | 用澄清石灰水鉴别氮气和二氧化碳 | |
| D. | 用相互刻画的方法鉴别黄铜片和铜片 |
10.下列物质中,既能与盐酸反应又能与氢氧化钠溶液反应的是( )
| A. | 葡萄糖 | B. | 氨基乙酸 | C. | 淀粉 | D. | 碳酸钠 |
7.下列是有关实验的叙述中,合理的是( )
①用氨水清洗做过银镜反应的试管
②不宜用瓷坩埚灼烧氢氧化钠固体
③使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤后烘干
④用酸式滴定管量取12.00mL高锰酸钾溶液
⑤使用pH试纸测定溶液pH时先润湿,测得溶液的pH都偏小
⑥配制FeSO4溶液时,需加入少量铁粉和稀硫酸.
①用氨水清洗做过银镜反应的试管
②不宜用瓷坩埚灼烧氢氧化钠固体
③使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤后烘干
④用酸式滴定管量取12.00mL高锰酸钾溶液
⑤使用pH试纸测定溶液pH时先润湿,测得溶液的pH都偏小
⑥配制FeSO4溶液时,需加入少量铁粉和稀硫酸.
| A. | ②④⑥ | B. | ②③⑥ | C. | ①②④ | D. | ②③④⑤⑥ |
14.某工厂的电镀污泥中含有铜、铁等金属化合物.为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:
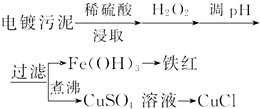
(1)酸浸后加入H2O2的目的是将Fe2+氧化成Fe3+,便于调整pH值与Cu2+分离.调pH步骤中加入的试剂最好是CuO、或Cu(OH)2、或CuCO3(填化学式).实验室进行过滤操作所用到的玻璃仪器有漏斗、烧杯、、玻璃棒.
(2)煮沸CuSO4溶液的原因是除净溶液中的H2O2,避免影响下一步CuCl的生成.
向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式2CuSO4+2NaCl+Na2SO3+H2O=2CuCl↓+2Na2SO4+H2SO4.
(3)Fe3+发生水解反应Fe3++3H2O?Fe(OH)3+3H+,该反应的平衡常数表达式为K=$\frac{c{\;}^{3}(H{\;}^{+})}{c(Fe{\;}^{3+})}$.
(4)称取所制备的CuCl样品0.250 0g置于一定量的0.5mol•L-1FeCl3溶液中,待样品完全溶解后,加水20mL,用0.100 0mol•L-1的Ce(SO4)2溶液滴定,到达终点时消耗Ce(SO4)2溶液25.00mL.有关的化学反应为Fe3++CuCl═Fe2++Cu2++Cl-,Ce4++Fe2+═Fe3++Ce3+.计算该CuCl样品的质量分数99.50%.

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 2.3 | 7.6 | 4.4 |
| 完全沉淀的pH | 3.2 | 9.7 | 6.4 |
(2)煮沸CuSO4溶液的原因是除净溶液中的H2O2,避免影响下一步CuCl的生成.
向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式2CuSO4+2NaCl+Na2SO3+H2O=2CuCl↓+2Na2SO4+H2SO4.
(3)Fe3+发生水解反应Fe3++3H2O?Fe(OH)3+3H+,该反应的平衡常数表达式为K=$\frac{c{\;}^{3}(H{\;}^{+})}{c(Fe{\;}^{3+})}$.
(4)称取所制备的CuCl样品0.250 0g置于一定量的0.5mol•L-1FeCl3溶液中,待样品完全溶解后,加水20mL,用0.100 0mol•L-1的Ce(SO4)2溶液滴定,到达终点时消耗Ce(SO4)2溶液25.00mL.有关的化学反应为Fe3++CuCl═Fe2++Cu2++Cl-,Ce4++Fe2+═Fe3++Ce3+.计算该CuCl样品的质量分数99.50%.
19.KMnO4是一种重要的氧化剂.
(1)①在酸性条件下KMnO4的氧化性会增强.用来酸化KMnO4溶液的最佳试剂是b.
a.硝酸 b.硫酸 c.盐酸
②将MnO4-氧化C2O42-的离子方程式补充完整:
2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O.
(2)某同学为了探究KMnO4溶液和Na2C2O4(草酸钠)溶液的反应过程,进行如下实验:
①配制100mL 0.0400mol•L的Na2C2O4溶液,除用到托盘天平、药匙、烧杯、量筒、玻璃棒等仪器外,还必须用到的玻璃仪器是100mL容量瓶、胶头滴管.
②将酸性KMnO4溶液逐滴滴入一定体积的Na2C2O4溶液中(温度相同,并不断振荡),记录的现象如下:
请分析KMnO4溶液褪色时间变化的可能原因反应生成的Mn2+对反应有催化作用,且c(Mn2+)浓度大催化效果更好.
③用配制好的0.0400mol•L的Na2C2O4溶液来标定某KMnO4溶液的浓度.每次准确量取25.00mLNa2C2O4溶液,然后用酸化后的KMnO4溶液滴定.滴定三次分别消耗的KMnO4溶液的体积是20.00mL、19.80mL、20.20mL,则KMnO4溶液的浓度为0.02mol/L.
(1)①在酸性条件下KMnO4的氧化性会增强.用来酸化KMnO4溶液的最佳试剂是b.
a.硝酸 b.硫酸 c.盐酸
②将MnO4-氧化C2O42-的离子方程式补充完整:
2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O.
(2)某同学为了探究KMnO4溶液和Na2C2O4(草酸钠)溶液的反应过程,进行如下实验:
①配制100mL 0.0400mol•L的Na2C2O4溶液,除用到托盘天平、药匙、烧杯、量筒、玻璃棒等仪器外,还必须用到的玻璃仪器是100mL容量瓶、胶头滴管.
②将酸性KMnO4溶液逐滴滴入一定体积的Na2C2O4溶液中(温度相同,并不断振荡),记录的现象如下:
| 滴入KMnO4溶液的次序 | KMnO4溶液紫色褪去所需的时间 |
| 先滴入第1滴 | 60s |
| 褪色后,再滴入第2滴 | 15s |
| 褪色后,再滴入第3滴 | 3s |
| 褪色后,再滴入第4滴 | 1s |
③用配制好的0.0400mol•L的Na2C2O4溶液来标定某KMnO4溶液的浓度.每次准确量取25.00mLNa2C2O4溶液,然后用酸化后的KMnO4溶液滴定.滴定三次分别消耗的KMnO4溶液的体积是20.00mL、19.80mL、20.20mL,则KMnO4溶液的浓度为0.02mol/L.