题目内容
4.(1)近年来,我国用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:3C+2K2Cr2O7+8H2SO4═3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O
完成并配平上述化学方程式.以上反应中失电子的物质是C,还原产物是Cr2(SO4)3,每生成1mol氧化产物,转移的电子数目为4NA.
(2)高温时,用CO还原MgSO4可制备高纯MgO.750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是CO+2MgSO4 $\frac{\underline{\;750℃\;}}{\;}$2MgO+CO2+SO2+SO3.
(3)向FeCl2和FeCl3混合溶液中加入适量KOH,高速搅拌下加入油脂,过滤后干燥得到一类特殊的磁流体材料,其化学式通式为KxFeO2(其组成可理解为aK2O•bFeO•cFe2O3).
①若x的平均值为1.3,a:b:c=13:6:7
②若x为1.4,请写出该磁流体在稀硫酸条件下与足量的KI溶液反应的化学方程式10K1.4FeO2+6KI+20H2SO4=10FeSO4+3I2+10K2SO4+20H2O.
(4)Fe3O4溶于稀HNO3的离子方程式:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O.
分析 (1)反应中C元素化合价变化:0价→+4价,1molC参加反应,失去4mol电子;Cr元素化合价变化:+6价→+3价,1molK2Cr2O7参加反应,得到6mol电子;依据氧化还原反应得失电子守恒、原子个数守恒规律书写方程式;依据方程式分析转移电子数目并用单线桥表示;
(2)根据题目信息写出生成物,根据质量守恒配平;
(3)①当x=1.3时,即KxFeO2为K1.3FeO2,其最简整数比的化学式为K13Fe10O20即$\frac{13}{2}$K2O•3FeO•$\frac{7}{2}$Fe2O3);
②当x=1.4时,即K1.4FeO2,当其在稀硫酸条件下与足量的KI溶液反应时,其反应实质是Fe3+和I-在酸性条件下发生氧化还原反应生成Fe2+和I2,K1.4FeO2的化学组成可看作7K2O•4FeO•3Fe2O3,
依据氧化还原反应得失电子守恒、原子个数守恒写出反应方程式;
(4)Fe3O4与稀硝酸反应生成硝酸铁、一氧化氮和水,利用整体法,Fe3O4中铁元素化合价共计+8价,生成3mol三价铁离子,共失去1mol电子,硝酸根中氮元素从+5价降为+2价,1mol硝酸根被还原得到3mol电子,依据氧化还原反应得失电子守恒及原子个数守恒配平方程式.
解答 解:(1)反应中C元素化合价变化:0价→+4价,1molC参加反应,失去4mol电子;Cr元素化合价变化:+6价→+3价,1molK2Cr2O7参加反应,得到6mol电子,要使得失电子守恒,则C的系数为3,K2Cr2O7的系数为2,依据原子个数守恒,反应方程式:3C+2K2Cr2O7+8H2SO4=3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O;
依据方程式3C+2K2Cr2O7+8H2SO4=3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O可知,消耗3mol碳生成3molCO2,共失去电子12mol;2K2Cr2O7共得到12mol电子,产物中CO2的化合价升高为氧化产物,Cr2(SO4)3的化合价降低为还原产物,每生成1mol氧化产物CO2,转移的电子4mol数目为N=n•NA=4NA;
故答案为:3;2;8H2SO4;3;2;2;8;C;Cr2(SO4)3;4NA;
(2)用CO还原MgSO4可得到MgO、CO2、SO2和SO3,方程式为CO+2MgSO4 $\frac{\underline{\;750℃\;}}{\;}$2MgO+CO2+SO2+SO3,
故答案为:CO+2MgSO4 $\frac{\underline{\;750℃\;}}{\;}$2MgO+CO2+SO2+SO3;
(3)①x=1.3时,即KxFeO2为K1.3FeO2,其最简整数比的化学式为K13Fe10O20即$\frac{13}{2}$K2O•3FeO•$\frac{7}{2}$Fe2O3);
则a:b:c=$\frac{13}{2}$:3:$\frac{7}{2}$;即:13:6:7;
故答案为:13:6:7;
②当x=1.4时,即K1.4FeO2,当其在稀硫酸条件下与足量的KI溶液反应时,其反应实质是Fe3+和I-在酸性条件下发生氧化还原反应生成Fe2+和I2,K1.4FeO2的化学组成可看作7K2O•4FeO•3Fe2O3,
反应的方程式:10K1.4FeO2+6KI+20H2SO4=10FeSO4+3I2+10K2SO4+20H2O;
故答案为:10K1.4FeO2+6KI+20H2SO4=10FeSO4+3I2+10K2SO4+20H2O;
(4)Fe3O4与稀硝酸反应生成硝酸铁、一氧化氮和水,利用整体法,Fe3O4中铁元素化合价共计+8价,生成3mol三价铁离子,共失去1mol电子,硝酸根中氮元素从+5价降为+2价,1mol硝酸根被还原得到3mol电子,要使得失电子守恒,Fe3O4系数为3,硝酸根离子系数为1,依据原子个数守恒,离子方程式:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O,
故答案为:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O.
点评 本题考查了氧化还原反应,涉及氧化还原反应表示方法、氧化还原反应方程式配平、有关计算,熟悉氧化还原反应中得失电子守恒规律是解题关键,题目难度较大.

①用氨水清洗做过银镜反应的试管
②不宜用瓷坩埚灼烧氢氧化钠固体
③使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤后烘干
④用酸式滴定管量取12.00mL高锰酸钾溶液
⑤使用pH试纸测定溶液pH时先润湿,测得溶液的pH都偏小
⑥配制FeSO4溶液时,需加入少量铁粉和稀硫酸.
| A. | ②④⑥ | B. | ②③⑥ | C. | ①②④ | D. | ②③④⑤⑥ |
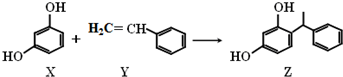
| A. | X、Y和Z均能与溴水发生反应,其中X、Z发生取代反应,Y发生加成反应 | |
| B. | X和Z均能NaOH溶液反应,也能与NaHCO3溶液反应放出CO2 | |
| C. | Y既能与H2发生加成反应,也能使酸性高锰酸钾溶液褪色 | |
| D. | Y可作加聚反应单体,X可作缩聚反应单体 |
| A. | ①②④ | B. | ②④⑤ | C. | ④⑤ | D. | ①② |
(1)①在酸性条件下KMnO4的氧化性会增强.用来酸化KMnO4溶液的最佳试剂是b.
a.硝酸 b.硫酸 c.盐酸
②将MnO4-氧化C2O42-的离子方程式补充完整:
2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O.
(2)某同学为了探究KMnO4溶液和Na2C2O4(草酸钠)溶液的反应过程,进行如下实验:
①配制100mL 0.0400mol•L的Na2C2O4溶液,除用到托盘天平、药匙、烧杯、量筒、玻璃棒等仪器外,还必须用到的玻璃仪器是100mL容量瓶、胶头滴管.
②将酸性KMnO4溶液逐滴滴入一定体积的Na2C2O4溶液中(温度相同,并不断振荡),记录的现象如下:
| 滴入KMnO4溶液的次序 | KMnO4溶液紫色褪去所需的时间 |
| 先滴入第1滴 | 60s |
| 褪色后,再滴入第2滴 | 15s |
| 褪色后,再滴入第3滴 | 3s |
| 褪色后,再滴入第4滴 | 1s |
③用配制好的0.0400mol•L的Na2C2O4溶液来标定某KMnO4溶液的浓度.每次准确量取25.00mLNa2C2O4溶液,然后用酸化后的KMnO4溶液滴定.滴定三次分别消耗的KMnO4溶液的体积是20.00mL、19.80mL、20.20mL,则KMnO4溶液的浓度为0.02mol/L.

在催化剂存在下,由苯和以下各组物质合成乙苯最好应选用的是( )
| A. | CH3CH3和Cl2 | B. | CH2=CH2和HCl | C. | CH2=CH2和Cl2 | D. | CH3CH3和HCl |
| A. | 多用电子邮件、MSN、QQ等即时通讯工具,少用传真打印机属于“低碳生活”方式 | |
| B. | 为加快漂白精的漂白速率,使用时可滴加几滴醋酸 | |
| C. | 我国神七宇航员所穿航天服主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料 | |
| D. | 视频《穹顶之下》再次引起公众对“PM2.5”的关注.“PM2.5”是指大气中直径小于或等于2.5×10-6m的细小颗粒物,这些颗粒扩散在空气中形成胶体 |
| A. | 过量的SO2通入NaOH溶液中:SO2+2OH-═SO32-+H2O | |
| B. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| C. | 过量NaOH滴入NH4HCO3稀溶液中:NH4++OH-═NH3•H2O | |
| D. | 铜片加入稀HNO3中:Cu+2NO3-+4H+═Cu2++2NO2↑+2H2O |