题目内容
5.六氟化硫分子呈正八面体(如图所示),在高电压下仍有良好的绝缘性,性质稳定,在电器工业方面有着广泛的用途,但逸散到空气中会引起强温室效应,下列有关六氟化硫的推测正确的是( )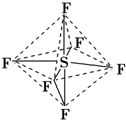
| A. | 六氟化硫中各原子均为8电子稳定结构 | |
| B. | 六氟化硫易燃烧生成二氧化硫 | |
| C. | 六氟化硫分子中含极性键、非极性键 | |
| D. | S-F键是σ键,且键长、键能都相等 |
分析 A.根据图片知,每个F原子和S原子形成一对共用电子对,每个S原子和六个F原子形成六对共用电子对;
B.SF6中F为-1价,则S为+6价,S元素不能再失电子,所以不能被氧化;
C.共价键极性的判断,同种原子间形成非极性键,不同原子间形成极性键;
D.六氟化硫分子中的S-F键都是σ键,为正八面体结构,键长、键能都相等.
解答 解:A.根据图片知,每个F原子和S原子形成一对共用电子对,每个S原子和六个F原子形成六对共用电子对,所以F原子都达到8电子稳定结构,但S原子最外层达到12电子,故A错误;
B.SF6中F为-1价,则S为+6价,S元素不能再失电子,所以不能被氧化,则六氟化硫不易燃烧生成二氧化硫,故B错误;
C.共价键极性的判断,同种原子间形成非极性键,不同原子间形成极性键,六氟化硫分子中的S-F键均为极性键,不含非极性键,故C错误;
D.六氟化硫分子中的S-F键都是σ键,为正八面体结构,所以键长、键能都相等,故D正确;
故选D.
点评 本题考查共价键极性判断、8电子稳定结构判断、物质性质等知识点,为高考高频点,侧重考查学生观察、获取信息、运用信息能力,易错选项是A,很多同学往往认为含有硫元素就能燃烧而导致错误判断.

练习册系列答案
相关题目
6.下列有机化合物中同分异构体数目最多的是(不考虑立体异构)( )
| A. | 丁烯 | B. | 戊烷 | C. | 丙醇 | D. | 二氯甲烷 |
13.已知反应:①2C(s)+O2(g)=2CO(g)△H=-221kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol
下列结论正确的是( )
②稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol
下列结论正确的是( )
| A. | 碳的燃烧热为△H=-110.5 kJ/mol | |
| B. | 1molC(s)所具有的能量一定高于1molCO(g)所具有的能量 | |
| C. | 稀硫酸与稀NaOH溶液反应的中和热为△H=-57.3 kJ/mol | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,也放出57.3 kJ 热量 |
10.已知X、Y、Z三种醇互为同系物,则建立在假设基础上的推断正确的是( )
| 假设 | 推断 | |
| A | 若X、Y均能发生消去反应 | Z一定能发生消去反应 |
| B | 若X是白酒的主要成分 | Y可能是丙三醇 |
| C | 若X、Y分子中分别有1个、2个碳原子 | Z的摩尔质量不小于60 g•mol-1 |
| D | 若X、Y均存在醇类同分异构体 | Z一定存在醇类同分异构体 |
| A. | A | B. | B | C. | C | D. | D |
17.下列原子或原子团不属于官能团的是( )
| A. | -CH3 | B. | -F | C. | -OH | D. |  |
14.电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:答下列有关问题:
(1)预测周期表中电负性最大的元素应为F;估计钙元素的电负性的取值范围:0.8<X<1.2
(2)根据表中的所给数据分析,同主族内的不同元素X的值变化的规律是同主族自上而下电负性降低.
(3)经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断AlBr3中形成的化学键的类型为共价键,其理由是因为AlCl3中Cl与Al的电负性差值为1.5,小于1.7,则AlCl3的键为共价键.而Br的电负性小于Cl,所以AlBr3中两元素的电负性差值也小于1.7,即AlBr3的键为共价键.
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
(2)根据表中的所给数据分析,同主族内的不同元素X的值变化的规律是同主族自上而下电负性降低.
(3)经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断AlBr3中形成的化学键的类型为共价键,其理由是因为AlCl3中Cl与Al的电负性差值为1.5,小于1.7,则AlCl3的键为共价键.而Br的电负性小于Cl,所以AlBr3中两元素的电负性差值也小于1.7,即AlBr3的键为共价键.
15.反应中,不能体现乙烯具有不饱和性的是( )
| A. | CH2=CH2+H2→CH3-CH3 | B. | CH2=CH2+3O2→2CO2+2H2O | ||
| C. | CH2=CH2+Br2→CH2Br-CH2Br | D. | CH2=CH2+H2O$\frac{\underline{\;催化剂\;}}{\;}$CH3CH2OH |