题目内容
20.已知:①2H2( g )+O2( g )=2H2O ( l );△H=-572kJ/mol②2H2( g )+O2( g )=2H2O ( g );△H=-484kJ/mol
③CH4 ( g )+2O2( g )=2H2O ( l )+CO2( g );△H=-890kJ/mol
(1)已知H-H的键能436kJ/mol O=O的键能496kJ/mol H-O的键能463kJ/mol,根据上述数据计算①②哪一个反应可以通过键能直接计算得出②.并计算写出反应 H2O ( l )=H2O ( g )的焓变△H=+44kJ•mol-1.
(2)请根据题干计算CO2(g)+4H2( g )=CH4( g )+2H2O( g )的焓变△H=-166kJ•mol-1;.
(3)在①②③三个方程式中哪一个是燃烧热的热化学方程式③.(填反应方程式的序号)
标准状况下,取甲烷和氢气的混合气体11.2L完全燃烧后恢复到常温,则放出的热量为26、3.8kJ,试求混合气体中甲烷和氢气体积比2:3.
分析 (1)根据反应热=反应物的键能总和-生成物的键能总和,根据盖斯定律计算反应 H2O ( l )=H2O ( g )的焓变△H;
(2)根据盖斯定律计算;
(3)燃烧热是指完全燃烧1mol物质生成稳定产物(液态水)所放出的热量,甲烷和氢气的混合气体11.2L(标准状况下),则其物质的量为0.5mol,设甲烷为xmol,氢气为ymol,根据物质的量之比等于热量比,结合热化学方程式计算.
解答 解:(1)根据反应热=反应物的键能总和-生成物的键能总和,△H=2×436+496-4×463=-484kJ/mol,与反应②的反应热相同,则反应②可通过键能直接计算得出;根据盖斯定律H2O ( l )=H2O ( g )的焓变△H=$\frac{②-①}{2}$=+44 kJ•mol-1;
故答案为:②;+44 kJ•mol-1;
(2)根据盖斯定律CO2(g)+4H2( g )=CH4( g )+2H2O( g )的焓变△H=①+②-③=-572kJ/mol+(-484kJ/mol)-(-890kJ/mol)=-166 kJ•mol-1
故答案为:-166 kJ•mol-1;
(3)燃烧热是指完全燃烧1mol物质生成稳定产物(液态水)所放出的热量,则反应③为燃烧热的热化学方程式;甲烷和氢气的混合气体11.2L(标准状况下),则其物质的量为0.5mol,设甲烷为xmol,氢气为ymol,
已知:2H2(g)+O2(g)=2H2O (l);△H=-572kJ/mol
2H2(g)+O2(g)=2H2O (g);△H=-484kJ/mol
CH4 (g)+2O2(g)=2H2O (l)+CO2(g);△H=-890kJ/mol
则xmol甲烷燃烧放出的热量为890xkJ,ymol氢气燃烧放出热量为$\frac{y}{2}$×572kJ,
所以890xkJ+$\frac{y}{2}$×572kJ=263.8,
x+y=0.5mol
解得:x:y=2:3,
故答案为:③;2:3.
点评 本题考查燃烧热的定义及根据热化学方程式及盖斯定律进行的有关反应热的计算,难度不大,理解热化学方程式的意义是关键,注意室温下水为液体.

| A. | 不是所有的烷烃中都既有极性键,又有非极性键 | |
| B. | 所有的烯烃中都是既有极性键,又有非极性键 | |
| C. | 在CCl4中碳元素呈现+4价 | |
| D. | 有机化学反应只能发生在极性键上 |
| A. | 电池工作时,锌失去电子 | |
| B. | 电池正极得电子反应产物是Mn2O3(s) | |
| C. | 电池工作时,电子由正极通过外电路流向负极 | |
| D. | 外电路中每通过O.2mol电子,锌的质量理论上减小6.5g |
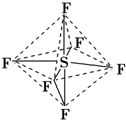
| A. | 六氟化硫中各原子均为8电子稳定结构 | |
| B. | 六氟化硫易燃烧生成二氧化硫 | |
| C. | 六氟化硫分子中含极性键、非极性键 | |
| D. | S-F键是σ键,且键长、键能都相等 |

| A. | 能与金属钠反应 | |
| B. | 能使石蕊试液变红 | |
| C. | 能发生银镜反应 | |
| D. | 1mol该酯与NaOH溶液反应,最多消耗3molNaOH |
①
 和
和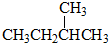
②
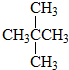 和
和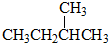
③CH4和CH3CH2CH3;
④金刚石和石墨:
⑤H、D、T;⑥16O、17O、18O;
⑦乙醇(CH3CH2OH)和甲醚(CH3OCH3);
⑧臭氧(O3)和氧气(O2).
| 类别 | 同位素 | 同素异形体 | 同系物 | 同分异构体 |
| 组号 |
| A. | NH3分子的电子式: | B. | CH4分子的比例模型: | ||
| C. | F原子的结构示意图: | D. | N2的结构式:N≡N |
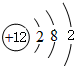 、
、 ,C的离子结构示意图
,C的离子结构示意图
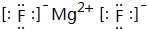 化学键类型为离子键.
化学键类型为离子键.